Etil eter

- 4546
- 1019
- Delbert Dare
 Ethyl eter adalah cecair yang tidak menentu dan mudah terbakar yang berfungsi sebagai anestetik pada abad kesembilan belas
Ethyl eter adalah cecair yang tidak menentu dan mudah terbakar yang berfungsi sebagai anestetik pada abad kesembilan belas Apa itu Ethyl Ether?
Dia etil eter, Juga dikenali sebagai Diety Ether, ia adalah sebatian organik yang formula kimianya adalah c4H10Sama ada. Ia dicirikan dengan menjadi cecair yang tidak berwarna dan tidak menentu, dan, oleh itu, botolnya mesti ditutup dengan ketat mungkin.
Eter ini. Iaitu, mereka mempunyai formula ror ', di mana r dan r' mewakili segmen berkarbonat yang berbeza. Dan seperti yang diterangkan oleh nama kedua, Diety Ether, adalah dua radikal -etil yang dikaitkan dengan atom oksigen.
Pada mulanya, etil eter digunakan sebagai anestetik umum, diperkenalkan pada tahun 1846 oleh William Thomas Green Morton. Walau bagaimanapun, disebabkan kemerosotannya, penggunaannya dibuang, menggantikannya dengan anestetik yang kurang berbahaya.
Kompaun ini juga telah digunakan untuk mengira masa peredaran darah, semasa penilaian status kardiovaskular pesakit.
Struktur Ethyl Ether
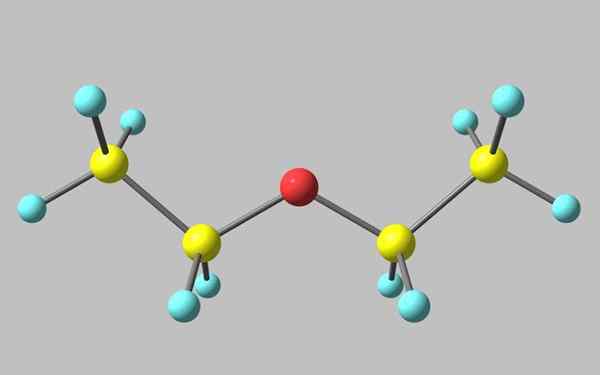 Struktur kimia etil eter
Struktur kimia etil eter Dalam imej yang unggul terdapat perwakilan dengan model sfera dan bar struktur molekul etil eter.
Seperti yang dapat dilihat, sfera merah, sepadan dengan atom oksigen, mempunyai dua kumpulan etil yang dikaitkan dengan kedua -dua belah pihak. Semua pautan adalah putaran mudah, fleksibel, dan bebas di sekitar paksi σ.
Putaran ini berasal stereoisomer yang dikenali sebagai conformer, yang lebih daripada isomer adalah keadaan ruang alternatif. Struktur imej sepadan dengan anti -konformer, di mana semua kumpulan atomnya terhuyung -huyung (dipisahkan antara satu sama lain).
Confruero yang lain dilepaskan, dan walaupun ia bukan imej yang tersedia, sudah cukup untuk memvisualisasikannya dengan u -shaped. Di hujung atas u kumpulan metil akan ditempatkan, -ch3, yang akan mengalami penolakan sterik (mereka akan bertembung di angkasa).
Boleh melayani anda: faraday constantOleh itu, dapat diharapkan molekul Cho3Ch2Och2Ch3 mengamalkan pembentukan anti sepanjang masa.
Sifat fizikal dan kimia etil eter
Nama lain
- Diethyl eter
- Etoxytano
- Etil oksida
Formula molekul
C4H10O o (c2H5)2Sama ada.
Berat molekul
74.14 g/mol.
Penampilan fizikal
Cecair tanpa warna.
Bau
Manis dan pedas.
Rasa
Terbakar dan manis.
Takat didih
94.3 ° F (34.6 ° C) pada 760 mm Hg.
Takat lebur
-177.3 ° F (-116.3 ° C). Kristal yang stabil.
titik pencucuhan
-49 ° F (bekas tertutup).
Kelarutan air
6.04 g/100 ml pada 25 ° C.
Kelarutan dalam cecair lain
Majazah dengan rantai pendek alifatik, benzena, kloroform, minyak eter, pelarut lemak, banyak minyak dan asid hidroklorik pekat.
Larut dalam aseton dan sangat larut dalam etanol. Ia juga larut dalam petrol, benzena dan minyak.
Ketumpatan
0.714 mg/ml pada 68 ° F (20 ° C).
Ketumpatan stim
2.55 (berhubung dengan udara yang diambil dengan ketumpatan 1).
Tekanan wap
442 mm Hg pada 68 ° F. 538 mm Hg pada 25 ° C. 58.6 kPa pada 20 ° C.
Kestabilan
Ia perlahan -lahan dioksidakan oleh tindakan udara, kelembapan dan cahaya dengan pembentukan peroksida.
Pembentukan peroksida boleh berlaku dalam bekas eter yang telah dibuka dan kekal dalam simpanan selama lebih dari enam bulan. Peroksida boleh mencetuskan geseran, kesan atau pemanasan.
Hubungannya dengan: zink, halogen, oxihaluros bukan logam, ejen pengoksidaan yang kuat, kromil klorida, minyak pokok, nitrat dan klorida logam harus dielakkan.
Pencucuhan diri
356 ° F (180 ° C).
Penguraian
Ketika dia menghangatkan, dia hancur, memancarkan asap dan menjengkelkan asap.
Goo
0.2448 sikap pada 20 ° C.
Haba pembakaran
8.807 kcal/g.
Ia boleh melayani anda: Einstenio (s): struktur, sifat, mendapatkan, menggunakanHaba pengewapan
89.8 Lime/g A 30 ° C.
Ketegangan permukaan
17.06 Dynas/cm pada 20 ° C.
Potensi pengionan
9.53 eV.
Ambang bau
0.83 ppm (kesucian tidak diberikan).
Indeks refraktif
1.355 hingga 15 ° C.
Memperoleh etil eter
Etil eter dari etil alkohol dapat diperoleh, dengan kehadiran asid sulfurik sebagai pemangkin. Asid sulfurik dalam medium berair yang memisahkan ion hidronium, h3Sama ada+.
Dalam proses yang bertentangan, iaitu penghidratan etilena dalam fasa stim, etil eter boleh dibentuk sebagai produk cagaran selain etil alkohol. Malah, laluan sintetik ini menghasilkan sebahagian besar sebatian organik ini.
Ketoksikan etil eter
Ia dapat menghasilkan kerengsaan kulit dan mata. Hubungan kulit dapat menghasilkan reseksi dan retak. Eter biasanya tidak menembusi kulit, kerana ia cepat disejat.
Kerengsaan mata yang disebabkan oleh eter biasanya ringan, dan dalam hal kerengsaan yang teruk, kerosakan umumnya boleh diterbalikkan.
Pengambilannya menghasilkan kesan narkotik dan kerengsaan perut. Pengambilan yang teruk boleh menyebabkan kerosakan buah pinggang.
Penyedutan eter boleh menyebabkan kerengsaan hidung dan tekak. Dalam kes penyedutan eter, ia boleh dihasilkan: mengantuk, keseronokan, pening, muntah, pernafasan yang tidak teratur dan peningkatan air liur.
Pendedahan yang tinggi boleh menyebabkan kehilangan pengetahuan dan juga kematian.
OSHA menetapkan had pendedahan buruh sebanyak 800 ppm secara purata, semasa peralihan 8 -hour.
Tahap Kerengsaan Mata: 100 ppm (Manusia). Tahap Kerengsaan Mata: 1200 mg/m3 (400 ppm).
Kegunaan/aplikasi etil eter
Pelarut organik
Ia adalah pelarut organik yang digunakan untuk membubarkan bromin, yodium dan halogen lain. Kebanyakan lipid (lemak), resin, karet tulen, beberapa alkaloid, karet, minyak wangi, selulosa asetat, nitrat selulosa, hidrokarbon dan pewarna.
Ia boleh melayani anda: tiada logam: sejarah, sifat, kumpulan, kegunaanDi samping itu, ia digunakan dalam pengekstrakan bahan -bahan aktif tisu haiwan dan tumbuh -tumbuhan, kerana ia mempunyai ketumpatan yang kurang daripada air dan terapung di atasnya, meninggalkan bahan yang dikehendaki dibubarkan dalam eter.
Anestesia Umum
Ia telah digunakan sebagai anestetik umum sejak tahun 1840, menggantikan kloroform kerana mempunyai kelebihan terapeutik. Walau bagaimanapun, ia adalah bahan mudah terbakar, dan, oleh itu, mendapati kesukaran yang teruk dalam penggunaannya di kawasan klinikal.
Di samping itu, ia menghasilkan pada pesakit beberapa kesan sampingan pasca operasi yang tidak diingini, seperti loya dan muntah.
Atas sebab -sebab ini, penggunaan eter telah dibuang sebagai anestetik umum, menggantikannya dengan anestetik lain seperti Halotano.
Semangat eter
Ether campuran etanol.
Penilaian peredaran darah
Ether telah digunakan untuk menilai peredaran darah antara satu lengan dan paru -paru. Eter disuntik ke dalam lengan, mengambil darah ke atrium kanan, kemudian ke ventrikel kanan dan dari sana ke paru -paru.
Masa yang hilang dari suntikan eter, ke penangkapan bau eter di udara yang dihembuskan, adalah kira -kira 4 hingga 6 s.
Makmal pengajaran
Eter digunakan dalam makmal pengajaran dalam banyak eksperimen. Contohnya, dalam demonstrasi undang -undang genetik Mendel.
Eter digunakan untuk membasahi lalat jantina Drosophila dan membenarkan salib yang diperlukan di antara mereka, untuk menyerlahkan undang -undang genetik.
Rujukan
- Graham Solomons t.W., Craig b. Fryhle. Kimia organik. Amina. Wiley Plus.
- Ethher Ether. Pulih dari Britannica.com

