Thermochemistry

- 1679
- 185
- Anthony Breitenberg
Kami menjelaskan bahawa ia adalah termokimia, kajian apa, undang -undang dan aplikasinya
 Dalam termokimia, pengubahsuaian haba dikaji dalam tindak balas kimia
Dalam termokimia, pengubahsuaian haba dikaji dalam tindak balas kimia Apakah termokimia?
The Thermochemistry Ia bertanggungjawab untuk mengkaji pengubahsuaian haba yang dijalankan dalam tindak balas antara dua atau lebih spesies kimia. Ia dianggap sebagai bahagian penting dari termodinamik, yang mengkaji transformasi haba dan jenis tenaga lain untuk memahami arah di mana proses dibangunkan dan bagaimana tenaga bervariasi.
Ia juga penting untuk memahami bahawa haba melibatkan pemindahan tenaga haba yang berlaku di antara dua badan, apabila ini pada suhu yang berbeza; Walaupun tenaga haba dikaitkan dengan pergerakan rawak yang mempunyai atom dan molekul.
Oleh itu, kerana hampir semua tindak balas kimia, tenaga diserap atau dibebaskan melalui haba, analisis fenomena yang berlaku melalui termokimia sangat relevan.
Apa kajian termokimia?
Thermochemistry mengkaji perubahan haba dalam bentuk haba yang berlaku dalam tindak balas kimia atau ketika proses yang menyiratkan transformasi fizikal berlaku.
Dalam pengertian ini, konsep tertentu mesti dijelaskan dalam subjek untuk pemahaman yang lebih besar mengenai perkara yang sama.
Sistem
Sebagai contoh, istilah "sistem" merujuk kepada segmen khusus alam semesta yang sedang dikaji, difahami sebagai "alam semesta" pertimbangan sistem dan persekitarannya (segala -galanya luaran untuk ini).
Oleh itu, sistem umumnya terdiri daripada spesies yang terlibat dalam transformasi kimia atau fizikal yang berlaku dalam reaksi. Sistem ini boleh diklasifikasikan kepada tiga jenis: terbuka, tertutup dan terpencil:
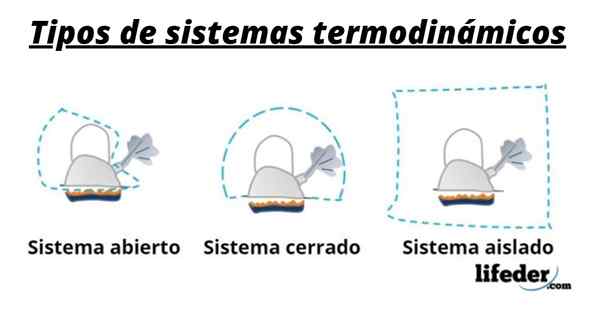
- Sistem terbuka adalah salah satu yang membolehkan pemindahan bahan dan tenaga (haba) dengan persekitarannya.
- Dalam sistem tertutup terdapat pertukaran tenaga tetapi bukan perkara.
- Dalam sistem terpencil, pemindahan bahan atau tenaga dalam bentuk haba tidak dibentangkan. Sistem ini juga dikenali sebagai "adiabatik".
Undang -undang termokimia
 Germain Hess, pencipta undang -undang Hess, asas kepada termokimia
Germain Hess, pencipta undang -undang Hess, asas kepada termokimia Undang -undang termokimia berkait rapat dengan undang -undang Laplace dan Lavoisier, serta undang -undang Hess, yang merupakan prekursor undang -undang termodinamik pertama.
Prinsip yang dinyatakan oleh Antoine Lavoisier Perancis (kimia penting dan mulia) dan Pierre-Simon Laplace (ahli matematik terkenal, fizikal dan astronomi) mengkaji bahawa "perubahan dalam tenaga yang ditunjukkan dalam mana-mana transformasi fizikal atau kimia mempunyai sama dan bermakna magnitud bertentangan dengan perubahan tenaga reaksi terbalik ".
Undang -undang Hess
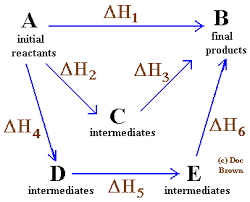
 Gambarajah ringkas dan umum di mana undang -undang hess untuk empat tindak balas kimia digunakan
Gambarajah ringkas dan umum di mana undang -undang hess untuk empat tindak balas kimia digunakan Dalam urutan idea yang sama, undang -undang yang dirumuskan oleh ahli kimia Rusia dari Switzerland, Germain Hess, adalah asas untuk penjelasan termokimia.
Prinsip ini berdasarkan tafsirannya tentang undang -undang pemuliharaan tenaga, yang merujuk kepada fakta bahawa tenaga tidak dapat dicipta atau dimusnahkan, hanya berubah.
Undang -undang Hess dapat diisytiharkan dengan cara ini: "Jumlah entalpi dalam tindak balas kimia adalah sama, sama ada reaksi dilakukan dalam satu langkah seolah -olah ia berlaku dalam urutan beberapa langkah".
Jumlah entalpi berlaku sebagai penolakan antara jumlah entalpi produk kecuali jumlah entalpi reaktan.
Dalam kes perubahan dalam entalpi standard sistem (dalam keadaan standard 25 ° C dan 1 atm), ia boleh dijangkau mengikut reaksi berikut:
Boleh melayani anda: asid klorogenikΔHtindak balas = ΣΔH(produk) - ΣΔH(reaktan)
Satu lagi cara untuk menerangkan prinsip ini, mengetahui bahawa perubahan entalpi merujuk kepada perubahan haba dalam reaksi apabila mereka diberikan kepada tekanan yang berterusan, mengatakan bahawa perubahan dalam entalpi bersih sistem tidak bergantung pada jalan yang mengikuti antara keadaan awal dan akhir.
Undang -undang termodinamik pertama
Undang -undang ini secara intrinsik dikaitkan dengan termokimia yang kadang -kadang keliru yang mana yang mengilhami yang lain; Oleh itu, untuk memberi lampu pada undang -undang ini, seseorang mesti bermula dengan mengatakan bahawa ia juga mempunyai akarnya dalam prinsip pemuliharaan tenaga.
Supaya termodinamik bukan sahaja mengambil kira haba sebagai satu bentuk pemindahan tenaga (seperti termokimia), tetapi juga melibatkan bentuk tenaga lain, seperti tenaga dalaman (Atau).
Oleh itu, variasi tenaga dalaman sistem (ΔU) diberikan oleh perbezaan antara keadaan awal dan terakhirnya (seperti yang dilihat dalam undang -undang Hess).
Mengambil kira bahawa tenaga dalaman terdiri daripada tenaga kinetik (pergerakan zarah) dan tenaga berpotensi (interaksi antara zarah) sistem yang sama, dapat disimpulkan bahawa terdapat faktor lain yang menyumbang kepada kajian keadaan dan sifat setiap sistem.
Aplikasi termokimia
Thermochemistry mempunyai pelbagai aplikasi, beberapa daripadanya akan disebutkan di bawah:
- Penentuan Perubahan Tenaga dalam Reaksi tertentu melalui Penggunaan Kalorimetri (Pengukuran Perubahan Haba dalam Sistem Terasing tertentu).
- Potongan perubahan entalpi dalam sistem, walaupun mereka tidak dapat dikenali dengan pengukuran langsung.
- Analisis pemindahan haba yang dihasilkan secara eksperimen apabila sebatian organometal dengan logam peralihan terbentuk.
- Kajian transformasi tenaga (dalam haba) yang diberikan dalam sebatian koordinasi poliames dengan logam.
- Penentuan enthalpies pautan logam-oksigen β-dice dan β-dice bersatu dengan logam.
- Serta dalam aplikasi terdahulu, termokimia boleh digunakan untuk menentukan sejumlah besar parameter yang berkaitan dengan jenis tenaga atau fungsi negara yang lain, yang mana yang menentukan status sistem pada masa tertentu.
- Thermochemistry juga digunakan dalam kajian pelbagai sifat kompaun, seperti dalam kalorimetri titrasi.
Rujukan
- Wikipedia. (s.F.). Thermochemistry. Diambil dari.Wikipedia.org
- Chang, R. (2007). Kimia, Edisi Kesembilan. Mexico: McGraw-Hill.
- Libretxts. (s.F.). Thermochemistry - Ulasan. Diperoleh dari chem.Libretxts.org
- Tyagi, ms. (2006). Thermochemistry. Pulih dari buku.Google.co.Pergi
- Ribeiro, m. Ke. (2012). Termokimia dan aplikasinya terhadap sistem kimia dan biokimia. Diperoleh dari buku.Google.co.Pergi
- Singh, n. B., Das, s. S., Dan Singh,. K. (2009). Kimia Fizikal, Jilid 2. Pulih dari buku.Google.co.Pergi

