Pembentukan tiocyanate, struktur, jenis, kegunaan
- 4632
- 1039
- Ms. Micheal Rippin
Dia Tiocianato Ia adalah anion bukan organik yang formulanya adalah SCN-. Inilah yang dikenali oleh pseudohalogenuro, kerana tingkah laku kimianya menyerupai halogenuros, iaitu fluorida, klorida, dll. Ia juga dikenali dengan nama Rodanida, walaupun ini tidak digunakan pada masa ini.
Tiocianate adalah spesies yang ingin tahu, kerana ia diposisikan di sempadan antara kimia organik dan bukan organik. Sempurna ia adalah sebahagian daripada sebatian organik dan bukan organik, hanya mengubah cara di mana ia dikaitkan atau interaksi. Pseudohalogenuro ini mempunyai hubungan biokimia yang kuat dengan ion sianida dan metabolisme mereka.
 Anion tiocyanate yang diwakili oleh model ruang penuh. Sumber: Benjah-bmm27 / domain awam.
Anion tiocyanate yang diwakili oleh model ruang penuh. Sumber: Benjah-bmm27 / domain awam. Dalam imej yang unggul terdapat perwakilan SCN- Menggunakan model ruang penuh. Sfera kuning sepadan dengan atom sulfur, manakala yang hitam dan kebiruan adalah atom karbon dan nitrogen. Tiocianate mempunyai abang oksigen: Cyanato, OCN-, di mana atom sulfur digantikan oleh oksigen.
Potassium Tiocianate, KSCN, adalah salah satu contoh yang paling mewakili untuk pseudohalogenuro ini. Sebaliknya, dalam kimia organik terdapat tiocianates yang formula umumnya adalah RSCN, seperti metil tiocianate, cho3Scn.
[TOC]
Latihan
Tindak balas antara sianida dan sulfur
Formula SCN- membolehkan anda melihat bahawa sintesisnya berdasarkan reaksi sianida, CN-, Dengan spesies yang menyumbangkan atom sulfur. Sesungguhnya, sianida dapat bertindak balas dengan sulfur asas, s8, atau dengan anion tiosulfat, s2Sama ada32- Untuk menghasilkan tiocyanate:
8 cn- + S8 → 8 scn-
CN- + S2Sama ada32- → SCN- + S2Sama ada32-
Boleh melayani anda: Jenis pautan CO2Walau bagaimanapun, tindak balas kedua dipangkin oleh sistem enzim yang terdiri daripada sulfurtransferase thiosulfate. Tubuh kita mempunyai enzim ini, dan oleh itu, kita dapat memetabolisme sianida yang berasal dari sianoglucosides (karbohidrat yang mempunyai kumpulan CN). Dengan cara ini, badan menghilangkan CN yang berbahaya-, yang mengganggu proses pernafasan selular.
Tiocianates dibubarkan dalam air liur dan, pada tahap yang lebih rendah, dalam plasma. Tahap kepekatan mereka mendedahkan bagaimana terdedah adalah individu untuk sianida, sama ada kerana pengambilan makanan yang berlebihan yang mengandunginya dalam bentuk semula jadi mereka (kacang, badam, kekacang, Linazas, dll.), atau dengan penyedutan yang berpanjangan asap rokok dan tembakau.
Neutralisasi Asid Tiocian
SCN- Ia boleh didapati dengan meneutralkan bentuk berasidnya: asid tiocianic, hscn atau isotiocyanic, hncs. Bergantung pada pangkalan yang digunakan, garam tiocianate juga akan diperolehi.
Struktur
Pautan
 Struktur resonans tiocianate. Sumber: Ben Mills melalui Wikipedia.
Struktur resonans tiocianate. Sumber: Ben Mills melalui Wikipedia. Imej unggul menunjukkan bagaimana beban negatif SCN diedarkan-. Perhatikan bahawa semua atom mempunyai hibridisasi SP2, Jadi mereka terletak di barisan yang sama.
Pasangan elektron boleh terletak pada atom nitrogen, atau pada atom sulfur. Fakta ini menerangkan ciri penting tiocianate: ia adalah ligan bident, iaitu, mampu menghubungkan dengan dua cara yang berbeza.
Isomería
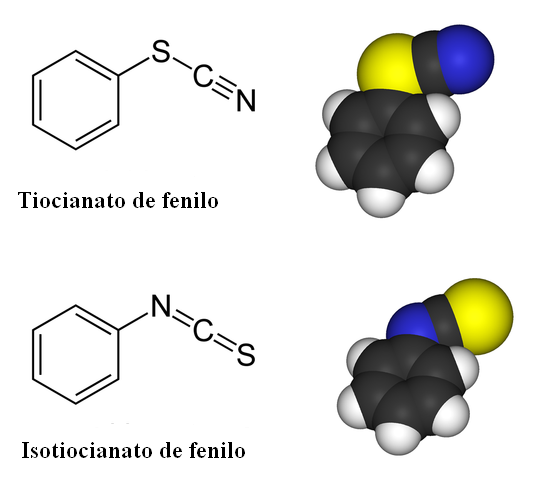
 Penghubung isomeria untuk fenil tiocyanate. Sumber: Benjah-bmm27 / domain awam
Penghubung isomeria untuk fenil tiocyanate. Sumber: Benjah-bmm27 / domain awam Dalam sebatian Tiocianate, isomer pautan hadir. Seperti yang dapat dilihat dalam imej yang unggul, SCN- Ia boleh dikaitkan dengan cincin benzenik atau kumpulan fenil sama ada oleh atom sulfur atau atom nitrogen. Apabila dikaitkan dengan S, ia dipanggil Tiocianate; Walaupun ketika dikaitkan dengan N, ia dipanggil Isotiocianate.
Boleh melayani anda: Stanislao CannizzaroPerhatikan bagaimana -scn atau -ncs kelihatan seperti serpihan linear. Geometri linear ini kekal tidak berubah dalam tiocianates organik dan tidak organik.
Ikatan -cs lebih kuat daripada -scn, kerana nitrogen, kerana ia lebih kecil, lebih baik menumpukan beban negatif pasangan elektron yang mana ikatan kovalen akan terbentuk.
Interaksi
Anion SCN- Mereka tidak dapat berinteraksi antara satu sama lain kerana penolakan elektrostatik. Oleh itu, mereka memerlukan kation supaya mereka dapat berinteraksi secara elektrostatik, dan dengan itu "membina" kristal. Tiocianates bukan organik adalah sebatian dalam intipati ionik.
Sementara itu, untuk tiocianates organik interaksi mereka adalah berdasarkan kuasa van der Waals; Terutama, jenis dipole-dipolo. Kumpulan SCN, sama ada yang dikaitkan, adalah kutub dan oleh itu menyumbang kepada peningkatan kutub kompaun. Jelas sekali, interaksi dipole-dipolo lebih lemah daripada tarikan ionik, hadir contohnya di KSCN+Scn-).
Tiocianates organik
Tiocianates organik diwakili dengan formula RSCN. Sebaliknya, mempunyai penghubung isomeria, kami juga mempunyai isoocianates, RNCS.
Oleh itu, sudah cukup untuk menggantikan R dengan serpihan molekul alkil atau aromatik untuk mendapatkan beberapa sebatian. Contohnya, CHO3Ch2SCN adalah etil tiocianate. Di bahagian sebelumnya r6H5Scn atau φ-scn.
Tiocianates tak organik
Tiocyanates tak organik dianggap garam asid tiocianic, HSCN, dan boleh diwakili sebagai MSCN, di mana m adalah kation logam atau kation ammonium. Oleh itu, kita mempunyai contoh:
-NASCN, Natrium Tiocyanate
-NH4SCN, Ammonium Tiocianate
Ia boleh melayani anda: perbezaan antara sebatian organik dan bukan organik-Iman (SCN)3, Ferric Tiocyanate
Banyak tiocianates tak organik adalah garam pepejal yang tidak berwarna.
Sebaliknya, kami juga mempunyai kompleks Tiocianate dalam penyelesaian. Sebagai contoh, penyelesaian berair yang mengandungi ion iman3+ akan disiapkan dengan ion SCN- Untuk membentuk [iman (NCS) (h2Sama ada)5]2+, yang berwarna merah.
Begitu juga, SCN- Ia dapat kompleks dengan kation logam lain, seperti CO2+, Cu2+ dan kamu4+, Masing -masing berasal dari kompleks yang berwarna -warni.
Aplikasi
Anion SCN- Ia digunakan untuk penentuan logam fotometrik dalam penyelesaian berair. Kaedah ini berdasarkan tepat pada pengukuran penyerapan kompleks Tiocianates yang berwarna -warni dengan logam.
Daripada penggunaan khusus ini, yang lain adalah berbeza seperti tiocianates yang wujud.
Tiocianates organik ditakdirkan lebih daripada apa -apa sebagai blok struktur untuk sintesis sebatian sulfur yang digunakan dalam bidang perubatan.
Sebaliknya, tiocianates tak organik yang mempunyai pewarnaan digunakan untuk industri tekstil atau sebagai bahan tambahan untuk lukisan bot. Juga, kerana ia adalah penderma ion yang baik-, Mereka diperlukan untuk pengeluaran racun serangga dan racun kulat.
Dari Tiocianates, yang paling popular adalah NASCN dan KSCN, kedua -duanya sangat diminta dalam industri dadah, pembinaan, elektronik dan agrokimia.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Thiocyanate. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2020). Thiocyanate. Pangkalan data PUBCHEM., CID = 9322. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Elsevier b.V. (2020). Thiocyanate. Scientedirect. Diperoleh dari: Scientedirect.com
- Nouryon. (2020). Thiocyanate. Diperolehi daripada: sulfurderivatif.Nouryon.com
- Riedel, k., Hagundan, h.W. Dan Scherer, g. (2013). Thiocyanate dalam plasma dan air liur [Kaedah Biomonitoring, 2013]. Di MAK - Koleksi untuk Kesihatan dan Keselamatan Pekerjaan (eds dan). Doi: 10.1002/3527600418.BI5712Sale0013

