Tioles
- 2564
- 365
- Horace Gulgowski
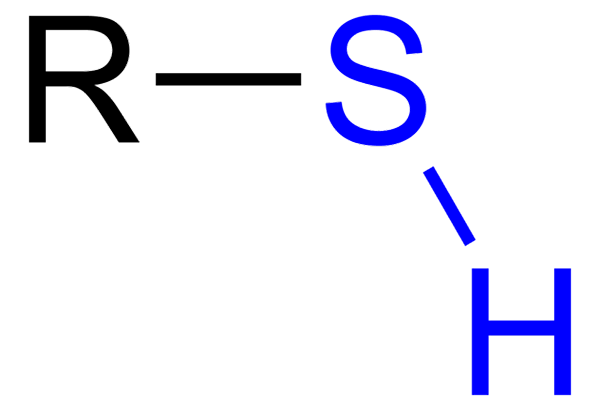
The Tioles Mereka adalah sebatian organik yang mempunyai kumpulan SH, yang dipanggil Tiol atau Sulfihydrilo Group. Formula umumnya ialah RSH, dapat mewakili r ke sewa, aril atau kumpulan kimia lain. Ciri tersendiri dari thioles adalah bau busuk yang kuat.
Beberapa thioles digunakan untuk menyampaikan bau gas mudah terbakar mereka, untuk mengesan kebocoran gas -gas ini, yang memberikan ciri -ciri mereka boleh menjadi bahaya besar. Tioles sama dengan alkohol, kerana mereka mempunyai kumpulan OH, sementara thioles a sh.
 Tiol dengan kumpulan sulfhydrillo biru
Tiol dengan kumpulan sulfhydrillo biru Walau bagaimanapun, mereka pula mempunyai beberapa perbezaan: kumpulan OH lebih kutub daripada kumpulan SH, dan sulfur adalah atom yang lebih kecil daripada oksigen dan kurang elektronegatif.
Ini menentukan bahawa molekul Thioles tidak membentuk ikatan hidrogen atau air atau di antara mereka. Oleh itu, kelarutan thioles di dalam air adalah rendah dan titik mendidihnya lebih rendah daripada alkohol dengan rantai karbon yang serupa.
Tioles sangat berguna dan kerap dalam sistem biokimia, kerana beberapa sesuai dengan biomolekul, seperti koenzim ke. Ikatan S-Hnya lebih berasid daripada O-H, lebih mudah untuk pecah, dan juga lebih mudah untuk menggantikan atau menggantikan serpihan molekul lain dalam banyak sintesis organik sulfur.
[TOC]
Sifat tioles
 Aroma berbau di kaki bukit terdiri daripada thioles
Aroma berbau di kaki bukit terdiri daripada thioles Umum
Kumpulan OH alkohol dan kumpulan SH tiole berkongsi satu set sifat fizikal dan kimia untuk kepunyaan oksigen dan sulfur kepada kumpulan kimia yang sama dalam jadual berkala (melalui kumpulan).
Loa tioéters, uniocetals dan thioésters, yang sama dengan sebatian kimia yang dibentuk oleh alkohol, seperti ether, asetal dan ester. Walau bagaimanapun, pautan S-H dan O-H menunjukkan beberapa perbezaan yang akan ditunjukkan dalam sifat-sifat Thioles dan Alkohol.
Bau
Ciri -ciri thioles berat molekul rendah adalah bau yang tidak menyenangkan, mirip dengan bawang putih dan bawang. Bau ini adalah magnitud sedemikian rupa sehingga bau manusia mempunyai ambang satu bahagian thiol untuk sepuluh bilion bahagian udara.
Etanotiol ditambah kepada gas asli sebagai langkah keselamatan, untuk mengesan mana -mana mudah terbakar tetapi tandas melarikan diri sendiri. Bau thioles berkurangan dengan meningkatkan bilangan karbon rantai mereka, kerana turun naik dan perkadaran tiol sulfur berkurangan.
Boleh melayani anda: ammonium fosfat: struktur, sifat, mendapatkan, kegunaanTitik mendidih dan kelarutan
Pautan S-H dari Thioles mempunyai momen dipole kurang daripada pautan O-H dari alkohol. Di samping itu, atom sulfur adalah elektronegativiti yang lebih kecil dan lebih kecil daripada atom oksigen.
Ini menentukan bahawa molekul Thioles tidak dapat membentuk ikatan hidrogen dengan air atau di antara mereka, menyebabkan perbezaan antara sifat fizikal thioles dan alkohol. Contohnya: Metanotiol (CHO3Sh) mempunyai titik mendidih 6 ºC, sementara metanol (CHO3Oh) mendidih pada suhu 65 ° C.
Oleh itu, pada suhu bilik (25 ºC) metanol adalah cecair dan metanotiol adalah gas.
Ringkasnya: Thioles mempunyai titik mendidih yang lebih rendah daripada alkohol yang disampaikan. Atas sebab yang sama, kelarutan thioles di dalam air dan pelarut kutub yang lain sangat rendah. Sementara itu, alkohol berat molekul rendah sangat larut dalam air.
Reaktiviti
Pautan S-H lebih lemah daripada ikatan O-H, jadi pautan S-H memisahkan lebih mudah, menjadikan asid kuat daripada alkohol. Sebilangan besar alkohol mempunyai PKA antara 16 dan 18, sementara Thioles mempunyai PKA sekitar 11.
Ini membolehkan Thioles-): Ejen nukleofilik yang sangat kuat.
Kumpulan SH boleh mengoksida untuk membentuk pautan disulfida (-s-s-) yang terdapat dalam pengoksidaan glutathionik: thiol hadir dalam sel dan mempunyai fungsi antioksidan.
Bromo atau halogen lain, serta oksigen, boleh bertindak pada thiol untuk membentuk jambatan disulfur:
2 RSH +BR → R-S-S-R '+2 HBR
Sebatian RSSR dikenali sebagai sulfida organik dan alkiiles, r, r2S.
Sebaliknya, agen pengoksidaan yang kuat, seperti natrium hipoklorit dan hidrogen peroksida, boleh bertindak pada thioles menyebabkan asid sulfonik:
Rsh +h2Sama ada2 → RSO3H +3 h2Sama ada
Nomenclature
Tata nama IUPAC untuk Thioles sangat serupa dengan alkohol: Nama Alkano dari mana akhiran 'Tiol' ditambahkan kepadanya.
Oleh itu, sebagai contoh, stano yang diperolehi oleh Stano dipanggil 1-Butanotiol, CH3Ch2Ch2Ch2SH, menunjukkan dengan nombor kedudukan kumpulan SH di karbon rantai.
Boleh melayani anda: kation: latihan, perbezaan dengan anion dan contohDengan cara yang sama ada tatanama lain, sekali lagi, sama dengan alkohol: perkataan 'alkohol' digantikan oleh 'mercaptan' dalam nama alkohol. Contohnya, CHO3SH, analog dengan metil alkohol, CH3Oh, dipanggil metil atau mercaptan mercaptan.
Contoh lain ialah Cho3Ch2CH (SH) CH3, Dipanggil 2-Butanotiol, Pedagang Secbutilic, atau Merchandise Secbutil. Iaitu, penekanan diberikan pada identiti r dalam formula RSH. Oleh itu, norma -norma tatanama yang lain untuk alkohol juga dipenuhi untuk thioles.
Dan akhirnya, apabila kumpulan SH hadir dalam struktur yang lebih besar atau di mana kumpulan yang paling penting mendominasi, awalan sulfihydrilo atau mercapto digunakan.
Contohnya, kompaun CH3Ch2CH (SH) COCH3 Ia dipanggil 3-mercapto-2-penona. Perhatikan bahawa SH mempunyai keutamaan yang kurang daripada kumpulan oksigen (kecuali eter), jadi angka kecil sesuai dengannya.
Sintesis
Kaedah sintesis thioles terdiri daripada tindak balas Tiota dengan alkil halida, yang menghasilkan garam perantaraan Isotiouron. Ini dihidrolisis oleh natrium hidroksida untuk mendapatkan thiol dan urea.
Ch3SH disediakan secara industri oleh tindak balas hidrogen sulfida dengan metanol, dengan kehadiran pemangkin asid:
Ch3Oh +h2S → Ch3Sh +h2Sama ada
Dalam kaedah pengeluaran yang lain, alkil halida bertindak balas dengan natrium hidrosulfuro:
Rx +nash → rsh +nax
Aplikasi
Penetapan enzim dikaitkan dengan nanopartikel
Tioles digunakan sebagai jambatan untuk menyertai kompleks nanoparticula-enzim kepada elektrod emas. Sebagai contoh, thioles digunakan untuk penetapan kompleks nanoparticle-uricasa, enzim yang campur tangan dalam penukaran asid urik ke allantoine.
Tiol -no reaksi
Ia adalah tindak balas organik antara tiol dan alkena, memanggil reaksi "klik"; Bahawa antara ciri -ciri lain, ia adalah tindak balas prestasi yang tinggi, skop luas, yang mewujudkan dihapuskan oleh produk -produk oleh kaedah bukan kromatografi, dan itu juga mudah dilakukan.
Reaksi thiol -no mempunyai aplikasi dalam sintesis Tioazúcar: Gula hadir di salicinol, perencat α -glikosidase. Salicinol telah diasingkan dari tumbuh -tumbuhan yang digunakan di Sri Lanka dan India dalam rawatan diabetes.
Di samping itu, tindak balas thiol -no digunakan dalam kimia karbohidrat, polimerisasi, kimia permukaan, kimia sintesis dan kimia peptida.
Boleh melayani anda: titik pembekuan: Cara mengira dan contohnyaBau
 Gas dapur adalah tandas, tetapi terima kasih kepada komposisi berat molekul yang rendah Thioles Ia mempunyai bau yang tersendiri
Gas dapur adalah tandas, tetapi terima kasih kepada komposisi berat molekul yang rendah Thioles Ia mempunyai bau yang tersendiri Thioles alifatik berat molekul rendah dimasukkan ke dalam gas asli supaya bau kuat mereka berfungsi sebagai amaran dalam menghadapi pelarian atau kebocoran gas.
Ubat
Penicilamine (c5HsebelasTidak2S) Ini adalah ubat yang digunakan dalam rawatan penyakit Wilson dan arthritis rheumatoid.
Dan captopril (c9Hlima belasTidak3S), sebaliknya, ia digunakan dalam rawatan hipertensi arteri dan penyakit jantung kongestif.
Kedua -duanya adalah contoh thioles dengan aplikasi ubat.
Biologi
Kumpulan Tioles hadir, antara sebatian lain dengan fungsi biologi, dalam cysteine, coenzyme A dan glutathione.
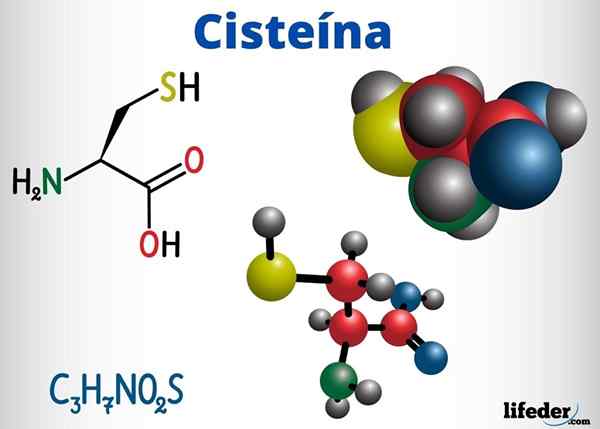
Cysteine adalah asid amino yang mampu membentuk jambatan disulfur dalam rantaian proteinnya, oleh itu, bertanggungjawab untuk struktur tertiari protein. Ia juga boleh membentuk jambatan disulfur antara rantai protein yang berbeza, menyebabkan struktur kuartal protein.
Cysteine terletak di pusat aktif pelbagai enzim dan juga mempunyai tindakan antioksidan.
Glutathion adalah tindakan intraselular antioksidan yang sangat penting, memberikan perlindungan kepada sel dan makromolekul yang membentuknya.
Coenzyme A, sebaliknya, adalah thiol yang campur tangan dalam sintesis dan pengoksidaan asid lemak. Di samping itu, koenzim di bawah bentuk acetylcoenzyme A, campur tangan pada permulaan kitaran asid sitrik atau kitaran Krebs.
Contoh
Akhirnya, beberapa nama thioles akan disenaraikan disertai dengan formula molekul mereka:
-Asid Tioacetic (c2H4Anda)
-Coenzyme A (cdua puluh satuH36N7Sama ada16P3S)
-Dikurangkan glutasi (c10H17N3Sama ada6S)
-Cysteine (c3H7Tidak2S)
-Mercaptanol (c2H6Anda)
-Metanotiol (Ch3Sh)
-1-propanotiol (c3H7Sh)
-Butanotiol (c4H 9Sh)
-Tiofenol atau Tiomerosal (c6H6S)
-Pomelo Mercaptano (C10H18S)
-HexadeCanotiol (c6H3. 4S)
-Penicillamine (c6HsebelasTidak2S)
-Captopril (c9Hlima belasTidak3S)
-Etanotiol (c2H6S)
-2-propenetiol (c3H6S)
-Α-lipoik atau lipoamide (c8H14Sama ada2S2). Ia adalah disulfida kitaran.
Rujukan
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Morrison dan Boyd. (1987). Kimia organik. (Edisi Kelima). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Thiol. Diperoleh dari: dalam.Wikipedia.org
- Dr. Dietmar Kennepohl et al. (13 September 2020). Thiols dan sulfida. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Editor enyclopaedia Britannica. (2020). Thiol. Pulih dari: Britannica.com
- Nolan MD dan Scanlan EM (2020) Aplikasi Kimia Thiol-ene untuk Sains Peptida. Depan. Chem. 8: 583272. Doi: 10.3389/fchem.2020.583272
- Dr. Carl c. Wamser. (1999). Bab 9: Alkohol dan Thiols. Diperolehi dari: web.Pdx.Edu

