Ciri, fungsi, degradasi, faedah treonine
- 3855
- 709
- Ms. Micheal Rippin
The Treonina (THR, T) atau TREO-α-AMINO-β-Butyric Acid adalah salah satu asid amino konstituen protein sel. Oleh kerana manusia dan haiwan vertebrata lain tidak mempunyai laluan biosintetik untuk pengeluarannya, Treonine dianggap sebagai salah satu daripada 9 asid amino penting yang mesti diperoleh dengan diet.
Treonine adalah yang terakhir dari 20 asid amino biasa yang ditemui dalam protein, fakta yang berlaku dalam sejarah lebih dari satu abad selepas penemuan asparagine (1806), yang merupakan asid amino pertama yang digambarkan.
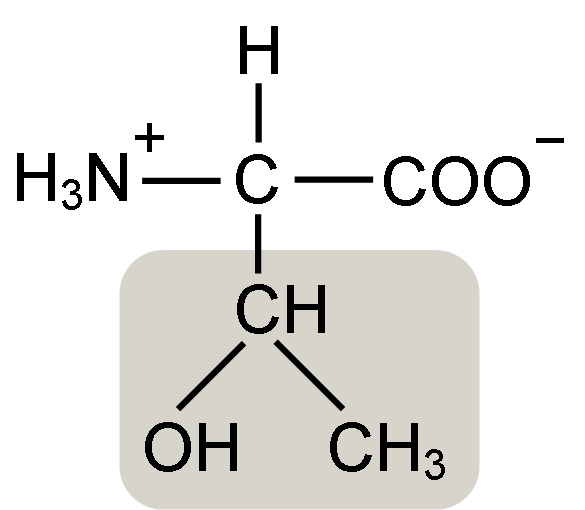
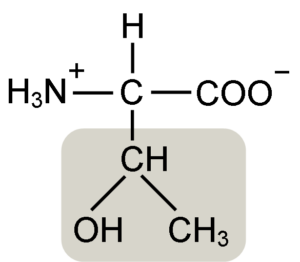 Struktur Asid Amino Treonine (Sumber: Keycin [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons)
Struktur Asid Amino Treonine (Sumber: Keycin [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons) Ia ditemui oleh William Cumming Rose pada tahun 1936, yang mencipta istilah "Treonine" untuk persamaan struktur yang dia dapati antara asid amino dan asid haraonik ini, sebatian yang diperolehi dari gula treose.
Sebagai protein asid amino, treonine mempunyai pelbagai fungsi dalam sel -sel, di antaranya tapak mengikat untuk rantai karbohidrat yang tipikal glikoprotein dan tapak pengiktirafan untuk kinase protein dengan fungsi tertentu (protein treonine/serine kinase) menonjol).
Begitu juga, Treonine adalah komponen penting protein seperti enamel pergigian, elastin dan kolagen dan juga mempunyai fungsi penting dalam sistem saraf. Ia digunakan sebagai suplemen makanan dan sebagai "mitigator" keadaan fisiologi kebimbangan dan kemurungan.
[TOC]
Ciri -ciri
Treonine milik kumpulan asid amino kutub yang mempunyai kumpulan r atau rantaian sampingan yang tidak mempunyai beban positif atau negatif (asid amino kutub yang tidak dimuatkan).
Ciri -ciri kumpulan Rnya dibuat oleh asid amino yang sangat larut (hidrofilik atau hidrofilik), yang juga berlaku untuk ahli -ahli kumpulan lain, seperti sistein, serine, asparagine dan glutamin.
Bersama-sama dengan tryptophan, phenylalanine, isoleucine dan tirosin, treonine adalah salah satu daripada lima asid amino yang mempunyai fungsi glucogenic dan ketogenik, kerana dari metabolismenya terdapat perantara yang relevan seperti piruvat dan succinyl-coA.
Asid amino ini mempunyai berat molekul anggaran 119 g/mol; Seperti banyak asid amino tanpa beban, ia mempunyai titik isoelektrik sekitar 5.87 dan kekerapannya dalam struktur protein hampir 6%.
Beberapa penulis mengumpulkan treonin bersama -sama dengan asid amino lain dari rasa "manis", antaranya, sebagai contoh, serine, glisin dan alanine.
Struktur
Asid α-amino seperti treonine mempunyai struktur umum, iaitu, biasa bagi semua. Ini dibezakan dengan kehadiran atom karbon yang dikenali sebagai "karbon α", yang merupakan kiral dan yang mana empat jenis molekul atau substituen yang berlainan disatukan.
Karbon ini berkongsi salah satu ikatannya dengan atom hidrogen, yang lain dengan kumpulan R, yang merupakan ciri untuk setiap asid amino, dan dua yang lain diduduki oleh kumpulan amino (NH2) dan karboksil (COOH), yang biasa untuk semua Asid amino.
Tonine Group R mempunyai kumpulan hidroksil yang membolehkannya membentuk jambatan hidrogen dengan molekul lain dalam media berair. Identiti beliau boleh ditakrifkan sebagai kumpulan alkohol (etanol, dengan dua atom karbon), yang telah kehilangan salah satu hidrogennya untuk menyertai atom karbon α (-chah-ch3).
Kumpulan ini -OH boleh berfungsi sebagai "jambatan" atau tapak kesatuan untuk pelbagai molekul (ini boleh disatukan, contohnya, rantai oligosakarida semasa pembentukan glikoprotein) jadi ia adalah salah satu yang bertanggungjawab untuk pembentukan pembentukan pembentukan derivatif treonine yang diubah suai.
Bentuk asid amino aktif secara biologi ini adalah L-treonine dan ini adalah yang mengambil bahagian dalam pembentukan struktur protein dan dalam pelbagai proses metabolik di mana ia bertindak.
Fungsi
Sebagai protein asid amino, treonine adalah sebahagian daripada struktur banyak protein dalam alam, di mana kepentingan dan kekayaannya bergantung kepada identiti dan fungsi protein yang dimiliki olehnya.
Boleh melayani anda: heterosis: peningkatan haiwan, tumbuhan, manusiaSebagai tambahan kepada fungsi strukturnya dalam pembentukan urutan protein peptida, Treonine memenuhi fungsi lain dalam sistem saraf dan hati, di mana ia mengambil bahagian dalam metabolisme lemak dan menghalang pengumpulannya dalam organ ini.
Treonine adalah sebahagian daripada urutan yang diiktiraf oleh enzim Serín/Treonina kinase, yang bertanggungjawab untuk pelbagai proses fosforilasi protein, penting untuk pengawalan pelbagai fungsi dan peristiwa isyarat intraselular.
Ia juga digunakan untuk rawatan beberapa gangguan usus dan pencernaan dan kegunaannya dalam pelemahan keadaan patologi seperti kebimbangan dan kemurungan telah ditunjukkan.
L-Treonine, juga, adalah salah satu asid amino yang diperlukan untuk mengekalkan keadaan pluripoten sel stem embrio tetikus, fakta yang nampaknya berkaitan dengan metabolisme s-adenosil-methionine dan dengan peristiwa metilasi histones, yang secara langsung terlibat dalam ekspresi gen.
Dalam industri
Harta biasa untuk banyak asid amino adalah keupayaannya untuk bertindak balas dengan kumpulan kimia lain seperti aldehid atau keton untuk pembentukan "rasa" ciri -ciri banyak sebatian.
Antara asid amino ini adalah treonine, yang sebagai serine, bertindak balas dengan sukrosa semasa TOS.
Treonine hadir dalam banyak ubat asal semula jadi dan juga dalam banyak formulasi suplemen pemakanan yang ditetapkan kepada pesakit yang mengalami kekurangan zat makanan atau yang mempunyai diet miskin dalam asid amino ini.
Satu lagi fungsi L-treonine yang paling terkenal, dan yang telah berkembang dari masa ke masa, adalah tambahan dalam penyediaan makanan pekat untuk babi dan industri pengeluaran unggas.
L-Treonine digunakan dalam industri ini sebagai suplemen makanan dalam formulasi yang lemah dari sudut pandangan protein, kerana ini memberikan kelebihan ekonomi dan melegakan kekurangan protein mentah yang dimakan oleh haiwan ladang ini.
Bentuk utama pengeluaran asid amino ini biasanya oleh penapaian mikrob dan angka pengeluaran dunia untuk tujuan pertanian untuk tahun 2009 melebihi 75 tan.
Biosintesis
Treonine adalah salah satu daripada sembilan asid amino penting untuk manusia, yang bermaksud bahawa ia tidak dapat disintesis oleh sel -sel badan dan, oleh itu, yang mesti diperoleh dari protein haiwan atau tumbuhan yang dibekalkan dengan diet harian.
Tanaman, kulat dan bakteria mensintesis treonine dari laluan yang sama yang dapat membentangkan beberapa percanggahan antara satu sama lain. Walau bagaimanapun, kebanyakan organisma ini bermula dari Asparto sebagai pendahulu, bukan hanya untuk treonine, tetapi juga untuk metodin dan lisin.
Laluan biosintetik dalam mikrob
Laluan biosintesis L-treonin dalam mikroorganisma seperti bakteria terdiri daripada lima langkah yang dikatalisis oleh enzim yang berbeza. Substrat berlepas, seperti yang dikomentari, adalah aspartat, yang fosforilasi oleh enzim ATP yang bergantung kepada quinasa aspartate.
Tindak balas ini menghasilkan fosfat L-asphat metabolit (L-aspartil-P) yang berfungsi sebagai substrat untuk aspartil aspartil semiadehida, yang memangkinkan penukarannya menjadi aspartil separuh bergantung separa yang bergantung kepada separuh.
Aspartyl semiiardhaide boleh digunakan untuk biosintesis L-lisin dan untuk biosintesis L-treonine; Dalam kes ini, molekul digunakan oleh enzim homoserin yang bergantung kepada enzim nadph untuk pengeluaran l-homoserina.
L-homoserine fosforilasi kepada L-homoserin fosfat (L-homoserina-p) oleh kinase yang bergantung kepada homoserin dan produk reaksi, pada gilirannya, adalah substrat enzim treonin sintesis, yang mampu mensintesis L-trinina.
L-methionine boleh disintesis dari L-homoserin yang dihasilkan dalam langkah sebelumnya, jadi ia mewakili laluan "kompetitif" untuk sintesis L-treonine.
L-treonine yang disintesis dengan cara ini boleh digunakan untuk sintesis protein atau juga boleh digunakan hiliran untuk sintesis glisin dan l-leucine, dua asid amino yang relevan juga dari sudut pandangan protein.
Boleh melayani anda: teori evolusiPeraturan
Adalah penting untuk menyerlahkan bahawa tiga daripada lima enzim yang mengambil bahagian dalam biosintesis L-treonin dalam bakteria dikawal oleh produk tindak balas oleh maklum balas negatif. Ini adalah aspartat kinase, dehidrogenase homoserin dan kinase homoserin.
Di samping itu, peraturan laluan biosintetik ini juga bergantung kepada keperluan selular produk biosintetik yang lain yang berkaitan dengannya, kerana pembentukan L-lisin, L-methionine, L-isoleucine dan glisin bergantung kepada laluan pengeluaran pengeluaran pengeluaran pengeluaran pengeluaran L-treonine.
Degradasi
Treonine boleh direndahkan oleh dua laluan yang berbeza untuk menghasilkan piruvat atau succinyl-CoA. Yang terakhir adalah produk yang paling penting dalam katabolisme treonin pada manusia.
Metabolisme Treonine berlaku terutamanya di hati, tetapi pankreas, walaupun pada tahap yang lebih rendah, turut mengambil bahagian dalam proses ini. Laluan ini bermula dengan pengangkutan asid amino melalui membran plasma hepatosit dengan cara pengangkut tertentu.
Pengeluaran piruvat dari Treonine
Penukaran treonine ke piruvat berlaku berkat transformasinya ke dalam glisin, yang berlaku dalam dua langkah pemangkin yang bermula dengan pembentukan 2-amino-3-ekotobutirat dari treonine dan oleh tindakan enzim dehydrogenase.
Di dalam manusia, laluan ini hanya mewakili antara 10 dan 30% daripada katabolisme Treonine, bagaimanapun, kepentingannya adalah relatif terhadap organisma yang dipertimbangkan sejak, sebagai mamalia lain, misalnya, ini lebih relevan secara kasar bercakap.
Pengeluaran succinil-Coa dari Treonina
Seperti metionin, valina dan isoleucine, atom karbon treonine juga digunakan untuk pengeluaran succunil-CoA. Proses ini bermula dengan penukaran asid amino ke α-cethobutirate, yang kemudiannya digunakan sebagai substrat enzim α-zo-stoat dehydrogenase untuk melaksanakan propionil-CoA.
Transformasi treonin ke α-cethobutirate dipangkin oleh enzim dehydratase, yang membayangkan kehilangan molekul air (H2O) dan satu lagi ion ammonium (NH4+).
Propionyl-CoA adalah karboksilat dalam methylmalonyl-CoA melalui tindak balas dua langkah yang memerlukan kemasukan atom karbon bikarbonat (HCO3-). Produk ini berfungsi sebagai substrat untuk metilmalonil-CoA mutasa-coenzyme B12 bergantung, yang "melambangkan" molekul untuk menghasilkan succinyl-CoA.
Produk katabolik lain
Di samping itu, kerangka karbon treonine boleh digunakan secara kasar untuk pengeluaran acetyl-CoA, yang juga mempunyai implikasi penting dari sudut tenaga dalam sel badan.
Dalam organisma tertentu, Treonine juga berfungsi sebagai substrat beberapa laluan biosintetik seperti isoleucine, sebagai contoh. Dalam kes ini, melalui 5 langkah pemangkin, α-ecthobutirate yang diperolehi dari katabolisme treonine dapat diarahkan ke arah pembentukan isoleucine.
Makanan yang kaya dengan Treonine
Walaupun kebanyakan makanan yang banyak dalam protein mempunyai peratusan tertentu dari semua asid amino, telah ditentukan bahawa telur, susu, soya dan gelatin sangat kaya dengan asid amino treonin.
Treonine juga dalam daging haiwan seperti ayam, babi, arnab, kambing dan pelbagai jenis burung. Dalam makanan asal tumbuhan ia banyak di dalam choles, pada bawang, bawang putih, chard dan terung.
Ia juga terdapat dalam beras, jagung, dedak gandum, bijirin kacang dan banyak buah -buahan seperti strawberi, pisang, anggur, nanas, plum dan kacang lain yang kaya dengan protein seperti kacang atau pistachios, antara lain.
Faedah pengambilan anda
Menurut Jawatankuasa Pakar Pertubuhan Kesihatan Sedunia untuk Pertanian dan Makanan (WHO, FAO), keperluan harian Treonina untuk manusia dewasa rata -rata adalah sekitar 7 mg per kilogram berat badan, yang mesti diperoleh dari makanan yang ditelan dengan diet.
Boleh melayani anda: merah fenol: ciri, penyediaan, aplikasiAngka -angka ini berasal dari data eksperimen yang diperolehi daripada kajian yang dijalankan dengan lelaki dan wanita, di mana jumlah treonin ini mencukupi untuk mendapatkan keseimbangan nitrogen positif dalam sel badan.
Walau bagaimanapun, kajian dengan kanak-kanak antara 6 bulan dan satu tahun telah menunjukkan bahawa untuk keperluan minimum l-treonine adalah antara 50 dan 60 mg per kilogram berat setiap hari.
Antara faedah utama pengambilan makanan tambahan atau ubat-ubatan dengan formulasi khas yang kaya dengan l-treonin adalah rawatan sclerosis amyotrophic lateral atau penyakit Lou Gehrig.
Bekalan Treonine tambahan nikmat penyerapan nutrien dalam usus dan juga menyumbang kepada peningkatan fungsi hati. Ia juga penting untuk pengangkutan kumpulan fosfat melalui sel.
Gangguan kekurangan
Pada kanak -kanak kecil terdapat kecacatan yang dilahirkan dalam metabolisme treonine yang menyebabkan kelewatan pertumbuhan dan gangguan metabolik lain yang berkaitan.
Kekurangan dalam asid amino ini dikaitkan dengan beberapa kegagalan dalam peningkatan berat badan kanak -kanak, sebagai tambahan kepada patologi lain yang berkaitan dengan kekurangan pengekalan nitrogen dan kehilangannya dalam air kencing.
Manusia yang tertakluk kepada diet yang buruk di Treonina boleh mengalami kecenderungan yang lebih besar untuk menderita hati berlemak dan beberapa jangkitan usus yang berkaitan dengan asid amino ini.
Rujukan
- Barret, g., & Elmore, D. (2004). Asid amino dan peptida. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Oh s. H., Condon, m., & Muda, v. R. (2002). Keperluan threonine orang dewasa yang sihat, dihukum dengan penunjuk 24-jam Teknik keseimbangan asid aminino. Jurnal Pemakanan Klinikal Amerika, 75(4), 698-704.
- Bradford, h. (1931). Sejarah penemuan asid amino. Ii. Kajian semula asid amino yang diterangkan sejak tahun 1931 sebagai komponen protein asli. Kemajuan dalam kimia protein, 81-171.
- Champe, ms., & Harvey, r. (2003). Asid amino asid amino. Dalam Ulasan Illustrated Lippincott: Biokimia (Edisi ke -3., ms. 1-12). Lippincott.
- De Lange, C. F. M., Gillis, a. M., & Simpson, G. J. (2001). Pengaruh pengambilan threonine pada pemendapan protein siapa-badan dan penggunaan threonine dalam babi yang semakin meningkat yang diberi makan diet yang disucikan. Jurnal Sains Haiwan, 79, 3087-3095.
- Edelman, a., Blumenthal, d., & Krebs, dan. (1987). Protein serine/threonine kinase. Annu. REV., 56, 567-613.
- Edsall, J. (1960). Asid aminino, protein dan biokimia kanser (Vol. 241). London: Akademik Press, Inc.
- Rumah, j. D., Hall, b. N., & Brosnan, J. T. (2001). Metabolisme threonine dalam hepatosit tikus terpencil. Jurnal Fisiologi Amerika - Endokrinologi dan Metabolisme, 281, 1300-1307.
- Hudson, b. (1992). Biokimia Protein Makanan. Springer-Science+Media Perniagaan, B.V.
- Kaplan, m., & Flavin, m. (1965). Biosintesis threonine. Di laluan kulat dan bakteria dan mekanisme tindak balas isomerisasi. Jurnal Kimia Biologi, 240(10), 3928-3933.
- Kidd, m., & Kerr, b. (Sembilan belas sembilan puluh enam). L-Threonine untuk Ayam: Ulasan. Sains Ayam Gunaan, INC., 358-367.
- Pratt, e., Snyderman, s., Cheung, m., Norton, ms., & Holt, dan. (1954). Keperluan threonine bayi biasa. Jurnal Pemakanan, 10(56), 231-251.
- Rigo, j., & Senterre, j. (1980). Pengambilan threonine optimum untuk preterm yang diberi makan pada pemakanan lisan atau parenteral. Jurnal Parenteral dan Pemakanan Enteral, 4(1), 15-17.
- Shyh-chang, n., Locasale, j. W., Lysssiotis, c. Ke., Zheng, dan., Teo, r. Dan., Ratanasirintrawoot, s.,... Cantley, l. C. (2013). Pengaruh metabolisme threonine pada s-adenensilmethionine dan metilasi histon. Sains, 339, 222-226.
- Vickery, h. B., & Schmidt, c. L. Ke. (1931). Sejarah penemuan asid amino. Ulasan Kimia, 9(2), 169-318.
- MD Web. (n.d.). Diperoleh pada 10 September 2019, dari www.Webmd.com/vitamin/ai/bahan-bahan-1083/threonine
- Wormser, e. H., & Pardee, ke. B. (1958). Peraturan biosintesis threonine di Escherichia coli. Arkib Biokimia dan Biofizik, 78(2), 416-432.
- Xunyan, x., Quinn, ms., & Xiaoyuan, x. (2012). Pintu Penyelidikan. Diperoleh pada 10 September 2019, dari www.Penyelidikan.bersih/angka/the-biosynthesis-pathway-of-l-threonine-the-pathway-consist-of-fi-ve-enzymmatic-steps_fig1_232320671

