Sejarah Tungsten, Hartanah, Struktur, Kegunaan

- 632
- 154
- Ms. Micheal Rippin
Dia tungsten, Wolframio atau Volframium adalah logam peralihan berat yang simbol kimianya adalah w. Ia terletak dalam Tempoh 6 dengan kumpulan 6 jadual berkala, dan nombor atomnya adalah 74. Namanya mempunyai dua makna etimologi: Batu keras dan busa serigala; Yang kedua adalah kerana logam ini juga dikenali sebagai Wolframio.
Ia adalah logam kelabu perak dan, walaupun ia rapuh, mempunyai kekerasan, ketumpatan, dan gabungan tinggi dan titik mendidih tinggi. Oleh itu, ia telah digunakan dalam semua aplikasi yang melibatkan suhu tinggi, tekanan atau daya mekanikal, seperti latihan, projektil, atau radiasi yang memancarkan filamen.
 Bar tungsten dengan permukaan yang teroksida sebahagiannya. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]
Bar tungsten dengan permukaan yang teroksida sebahagiannya. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)] Penggunaan yang paling terkenal untuk logam ini, di budaya dan tahap popular, adalah dalam filamen mentol elektrik. Yang telah memanipulasi mereka akan menyedari betapa rapuhnya mereka; Walau bagaimanapun, mereka tidak diperbuat daripada tungsten tulen, yang mudah dibentuk dan mulur. Di samping itu, dalam matriks logam seperti aloi, ia memberikan ketahanan dan kekerasan yang sangat baik.
Ia dicirikan dan dibezakan dengan menjadi logam dengan titik gabungan tertinggi, dan untuk menjadi lebih padat daripada petunjuk yang sama, hanya dilepasi oleh logam lain seperti osmium dan iridium. Ia juga merupakan logam paling berat yang diketahui memenuhi peranan biologi dalam badan.
Dalam kebanyakan sebatian ioniknya, anion tungstate mengambil bahagian, wo42-, yang boleh polimerisasi menyebabkan kelompok dalam medium berasid. Sebaliknya, tungsten boleh membentuk sebatian intermetallic, atau sterin dengan logam atau garam bukan organik supaya pepejal mereka memperoleh bentuk atau konsistensi yang berbeza.
Ia tidak begitu banyak di korteks bumi, mempunyai satu tan itu hanya 1.5 gram logam ini. Di samping itu, kerana ia adalah elemen yang berat, asalnya adalah intergalactic; Khususnya letupan supernovas, yang terpaksa membuang "jet" atom tungsten ke planet kita semasa pembentukannya.
[TOC]
Sejarah
Etimologi
Sejarah Tungsten atau Wolframio mempunyai dua muka serta nama mereka: Satu Switzerland, dan Jerman yang lain. Pada tahun 1600 -an, di kawasan yang kini diduduki oleh Jerman dan Austria, pelombong bekerja pada pengekstrakan tembaga dan timah untuk menghasilkan gangsa.
Pada masa itu para pelombong bertemu duri dalam proses: terdapat mineral yang sangat sukar; Mineral terdiri daripada wolframite, (iman, mn, mg) wo4, yang dikekalkan atau "dimakan" timah seolah -olah ia adalah serigala.
Oleh itu etimologi untuk elemen ini, 'serigala' serigala dalam bahasa Sepanyol, serigala yang makan timah; dan 'ram' buih atau krim, yang kristalnya menyerupai bulu hitam panjang. Itu supaya nama 'Wolfram' atau 'Wolframio' muncul untuk menghormati pemerhatian pertama ini.
Pada tahun 1758, di sebelah Switzerland ke mineral yang sama, Scheelita, Cawo4, Dia dinamakan 'tung sten', yang bermaksud 'batu keras'.
Kedua -dua nama, Wolframio dan Tungsten, digunakan secara meluas secara bergantian, bergantung semata -mata pada budaya. Di Sepanyol, sebagai contoh, dan di Barat Eropah, logam ini lebih dikenali oleh Wolframio; Semasa di benua Amerika nama Tungsten mendominasi.
Pengiktirafan dan penemuan
Ia kemudian diketahui bahawa antara abad ke -17 dan kelapan belas terdapat dua mineral: Wolframite dan Scheelita. Tetapi yang melihat bahawa terdapat logam yang berbeza dari yang lain? Mereka hanya boleh dicirikan sebagai mineral, dan pada tahun 1779 bahawa ahli kimia Ireland Peter Woulfe dengan teliti menganalisis Wolframite dan menyimpulkan kewujudan Wolframium.
Ia boleh melayani anda: asid percomic (HBRO4): sifat, risiko dan kegunaanDi sisi Switzerland, sekali lagi, Carl Wilhelm Scheele pada tahun 1781 dapat mengasingkan tungsten sebagai wo3; Dan lebih banyak lagi, dia memperoleh asid tumatik (atau wolphramik), H2Wo4 dan sebatian lain.
Walau bagaimanapun, ini tidak mencukupi untuk mencapai logam tulen, kerana perlu untuk mengurangkan asid ini; iaitu, tertakluk kepada proses sedemikian yang tidak akan dapat oksigen dan mengkristal sebagai logam. Carl Wilhelm Scheele tidak mempunyai metodologi yang sesuai untuk reaksi pengurangan kimia ini.
Di sinilah saudara -saudara Sepanyol D'Aluyar, Fausto dan Juan José, yang mengurangkan kedua -dua mineral (Wolframite dan Scheelita) dengan arang batu, di bandar Bergara, di bandar Bergara. Dua diberikan merit dan kehormatan menjadi penemu Wolframium atau Tungsten Metalik (W).
Keluli dan mentol
 Mana -mana mentol dengan filamen tungsten. Sumber: Pxhere.
Mana -mana mentol dengan filamen tungsten. Sumber: Pxhere. Seperti logam lain, kegunaannya menentukan sejarahnya. Antara yang paling menonjol menjelang akhir abad ke-19, adalah aloi keluli-tungsten, dan filamen tungsten untuk menggantikan karbon di dalam mentol elektrik. Dikatakan bahawa mentol pertama, seperti yang kita ketahui, dipasarkan pada tahun 1903-1904.
Sifat
Penampilan fizikal
Ia adalah logam kelabu perak dan berkilau. Rapuh tetapi kekerasan yang besar (tidak mengelirukan dengan ketabahan). Sekiranya sekeping adalah kesucian yang tinggi ia menjadi lembut dan keras, kedua -duanya atau lebih dan beberapa keluli.
Nombor atom
74.
Jisim molar
183.85 g/mol.
Takat lebur
3422ºC.
Takat didih
5930ºC.
Ketumpatan
19.3 g/ml.
Haba Fusion
52.31 kJ/mol.
Haba pengewapan
774 kJ/mol.
Kapasiti haba molar
24.27 kJ/mol.
Kekerasan Koh
7.5.
Elektronegativiti
2,36 pada skala Pauling.
Radio atom
139 malam
Resistiviti elektrik
52.8 nΩ · m pada 20ºC.
Isotop
Ia membentangkan kebanyakannya sebagai lima isotop: 182W, 183W, 184W, 186Tongkat 180W. Menurut jisim molar 183 g/mol, yang purata jisim atom isotop ini (dan tiga puluh radioisotop lain), setiap atom tungsten atau wolframium mempunyai kira -kira seratus sepuluh neutron (74 + 110 = 184).
Kimia
Ia adalah sangat tahan terhadap logam kakisan, kerana lapisan nipisnya3 melindunginya terhadap serangan oksigen, asid dan alkali. Sebaik sahaja dibubarkan dan dicetuskan dengan reagen lain, garam mereka diperoleh, yang dipanggil wolframates atau tungstates; Di dalamnya tungsten mempunyai keadaan pengoksidaan +6 (dengan mengandaikan bahawa terdapat kation w6+).
Clustering asid
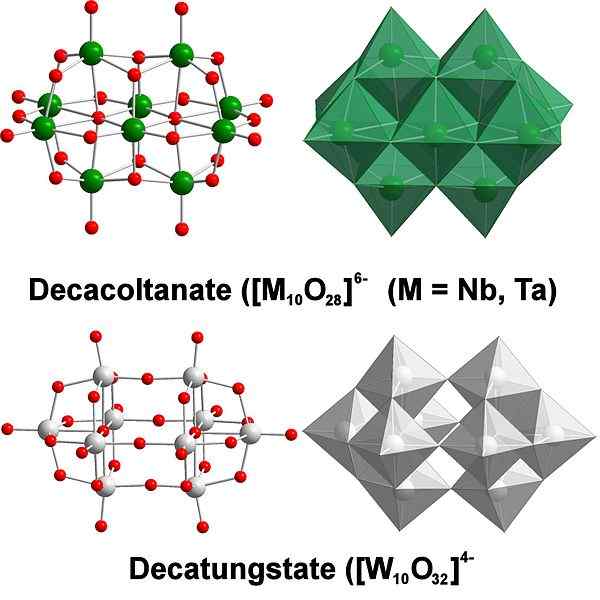 Decatungstate, contoh tungsten polyaxomethalates. Sumber: Scifanz [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Decatungstate, contoh tungsten polyaxomethalates. Sumber: Scifanz [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Secara kimia tungsten agak khusus kerana ionnya cenderung dikelompokkan (kluster dalam bahasa Inggeris) untuk membentuk heteropolikid atau polyaxomethalate. Apakah mereka? Mereka adalah kumpulan atau kelompok atom yang mengikat untuk menentukan badan tiga dimensi; terutamanya, satu dengan struktur sangkar sfera, di mana mereka "melampirkan" atom lain.
Semuanya bermula dari anion tungstate, wo42-, Yang dalam medium berasid diproton (hwo4-) dan dikaitkan dengan anion jiran untuk membentuk [w2Sama ada7(Oh)2]2-; Dan ini seterusnya bergabung dengan yang lain [w2Sama ada7(Oh)2]2- Berasal dari [w4Sama ada12(Oh)4]4-. Jadi pada penyelesaiannya terdapat beberapa polytungstates.
Boleh melayani anda: lithium chloride (LICL): sifat, risiko dan kegunaanParathungstate a dan b, [w7Sama ada24]6- dan h2W12Sama ada4210-, masing -masing, mereka adalah salah satu yang paling luar biasa dari poli ini.
Ia boleh menjadi satu cabaran untuk mempertimbangkan struktur lakaran dan Lewis; Tetapi sudah cukup pada dasarnya untuk memvisualisasikannya sebagai set octahedra6 (gambar atas).
Perhatikan bahawa octahedra abu -abu ini akhirnya mendefinisikan decatungstate, sebuah politik; Sekiranya terkunci heteroátomo di dalam (contohnya, fosforus), ia akan menjadi polyaxomethalate.
Struktur dan konfigurasi elektronik
Fasa kristal
Atom tungsten menentukan struktur padu yang berpusat dengan badan (BCC, oleh Kubik berpusatkan badan). Bentuk kristal ini dikenali sebagai fasa α; Walaupun fasa β juga padu, tetapi sedikit padat. Kedua -dua fasa atau bentuk kristal, α dan β, boleh wujud bersama dalam keadaan normal.
Biji kristal fasa α adalah isometrik, manakala fasa β menyerupai lajur. Tidak kira bagaimana kaca itu, dalam pemerintahan ini. Jika tidak, titik lebur dan mendidih yang tinggi tidak dapat dijelaskan, atau kekerasan dan ketumpatan tinggi tungsten.
Pautan logam
Atom tungsten entah bagaimana mesti bersatu. Untuk menimbulkan tekaan, konfigurasi elektronik logam ini harus diperhatikan sebelum ini:
[Xe] 4f145 d46s2
Orbital 5d sangat besar dan kabur, yang akan menyiratkan bahawa antara dua atom dekat terdapat tumpang tindih orbital yang berkesan. Juga, Orbitals 6s menyumbang kepada band yang dihasilkan, tetapi pada tahap yang lebih rendah. Sementara orbital 4f mempunyai "sangat mendalam" dan sumbangan mereka ke pautan logam lebih rendah.
Ini, saiz atom, dan bijirin kristal, adalah pembolehubah yang menentukan kekerasan tungsten dan ketumpatannya.
Keadaan pengoksidaan
Dalam tungsten atau metalik wolframium atom W mempunyai keadaan pengoksidaan sifar (w0). Kembali ke konfigurasi elektronik, orbital 5d dan 6s boleh "kosong" elektron bergantung jika W berada di dalam syarikat atom elektronegatif, seperti oksigen atau fluorin.
Apabila kedua -dua elektron 6s hilang, tungsten mempunyai keadaan pengoksidaan +2 (w2+), Apa yang menjana kontrak atomnya.
Sekiranya anda juga kehilangan semua elektron orbital 5D anda, status pengoksidaan anda akan menjadi +6 (w6+); Dari sini ia tidak boleh menjadi lebih positif (dalam teori), kerana orbital 4f untuk menjadi dalaman memerlukan tenaga yang besar untuk menghilangkan elektron mereka. Iaitu keadaan pengoksidaan yang paling positif adalah +6, di mana tungsten masih kecil.
Tungsten (vi) ini sangat stabil dalam keadaan berasid atau dalam banyak sebatian oksigen atau halogenasi. Keadaan pengoksidaan positif dan mungkin lain adalah: +1, +2, +3, +4, +5 dan +6.
Tungsten juga boleh mendapatkan elektron jika digabungkan dengan atom elektronegatif yang kurang daripada dia. Dalam kes ini, atom mereka menjadi lebih besar. Ia boleh mendapatkan maksimum empat elektron; iaitu, mempunyai keadaan pengoksidaan -4 (w4-).
Memperoleh
Sebelum ini, sebutkan dibuat bahawa tungsten ditemui di Wolframite dan Scheelita Mineral. Bergantung pada prosesnya, dua sebatian diperolehi daripada mereka: tungsten oksida, wo3, atau ammonium paratungstate, (NH4)10(H2W12Sama ada42) · 4h2O (atau ATP). Mana -mana daripada mereka berdua boleh dikurangkan menjadi logam W dengan arang batu melebihi 1050ºC.
Ia boleh melayani anda: Undang -undang Raault: Prinsip dan Formula, Contoh, LatihanIa tidak menguntungkan secara ekonomi. Itulah sebabnya lebih disukai untuk menghasilkannya dalam bentuk habuk untuk sekali berurusan dengan logam lain untuk mendapatkan aloi.
Perlu dinyatakan bahawa dunia China adalah negara dengan pengeluaran terbesar tungsten. Dan di benua Amerika, Kanada, Bolivia dan Brazil, mereka juga menduduki senarai pengeluar terbesar logam ini.
Aplikasi
 Sebatian karbida tungsten: Contoh bagaimana kekerasan logam ini dapat digunakan untuk abadi dan mengeras bahan. Sumber: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Sebatian karbida tungsten: Contoh bagaimana kekerasan logam ini dapat digunakan untuk abadi dan mengeras bahan. Sumber: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Beberapa kegunaan yang diketahui untuk logam ini disebutkan di bawah:
-Garamnya digunakan untuk mewarnai pakaian teater lama.
-Digabungkan dengan keluli ia lebih mengeras, bahkan dapat menahan pemotongan mekanikal pada kelajuan tinggi.
-Filamen sintering tungsten telah digunakan selama lebih dari seratus tahun dalam mentol elektrik dan lampu halogenasi. Juga, kerana titik lebur yang tinggi ia telah berfungsi sebagai bahan untuk tiub sinar katod, dan untuk muncung enjin roket.
-Menggantikan plumbum dalam pembuatan projektil dan perisai radioaktif.
-Nanocables tungsten boleh digunakan dalam nanodispositive pH -sensitif.
-Pemangkin Tungsten digunakan untuk menangani pengeluaran sulfur dalam industri minyak.
-Tungsten Carbide adalah dari semua sebatiannya yang meliputi lebih banyak kegunaan. Dari pengukuhan alat pemotongan dan penggerudian, atau pembuatan kepingan senjata tentera, untuk mekanisasi kayu, plastik dan seramik.
Risiko dan langkah berjaga -jaga
Biologi
Menjadi logam yang agak jarang berlaku di kerak bumi, kesan negatifnya jarang berlaku. Dalam tanah berasid, polytungstates mungkin tidak menjejaskan enzim yang digunakan oleh molybdates; Tetapi di tanah asas, wo42- Ia campur tangan (positif atau negatif) dalam proses metabolik Moo42- dan tembaga.
Tanaman, misalnya, dapat menyerap sebatian larut tungsten, dan dengan memakannya haiwan dan kemudian setelah memakan daging mereka, atom W memasuki organisma kita. Kebanyakannya diusir dalam air kencing dan najis, dan sedikit diketahui apa yang berlaku kepada yang lain.
Kajian haiwan menunjukkan bahawa apabila kepekatan serbuk tungsten tinggi mengembangkan gejala yang serupa dengan kanser paru -paru.
Dengan pengambilan, manusia dewasa perlu minum beribu -ribu gelen air yang diperkaya dengan garam tungsten untuk menunjukkan perencatan enzim colinesterase dan fosfatase yang ketara.
Fizikal
Secara umum, tungsten adalah unsur toksik yang sedikit, dan oleh itu terdapat sedikit risiko tuan rumah terhadap kerosakan kesihatan.
Mengenai tungsten logam, anda harus mengelakkan bernafas habuknya; Dan jika sampelnya pepejal, ia mesti diambil kira bahawa ia sangat padat dan ia boleh menyebabkan kerosakan fizikal jika jatuh atau mencecah permukaan lain.
Rujukan
- Bell Terence. (s.F.). Tungsten (Wolfram): Hartanah, Pengeluaran, Aplikasi & Alloys. Baki. Pulih dari: theBalance.com
- Wikipedia. (2019). Tungsten. Diperoleh dari: dalam.Wikipedia.org
- Lentech b.V. (2019). Tungsten. Pulih dari: lentech.com
- Jeff Desjardins. (1 Mei 2017). Sejarah tungsten, logam semulajadi terkuat di bumi. Pulih dari: visualcapitalis.com
- Doug Stewart. (2019). Fakta elemen tungsten. Pulih dari: chemicool.com
- Art Fisher dan Pam Powell. (s.F.). Tungsten. Universiti Nevada. Pulih dari: unce.a r.Edu
- Helmestine, Anne Marie, Ph.D. (2 Mac, 2019). Fakta Tungsten atau Wolfram. Pulih dari: Thoughtco.com

