Lithium oxide
- 3867
- 522
- Mr. Tracy Parisian
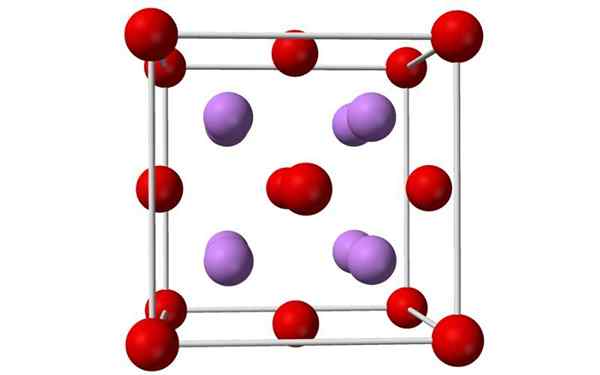
 Model sfera dan bar sel lithium oksida kesatuan. Sumber: Benjah-bmm27, Wikimedia Commons
Model sfera dan bar sel lithium oksida kesatuan. Sumber: Benjah-bmm27, Wikimedia Commons Apa itu Lithium Oxide?
Dia Lithium oxide Ia adalah sebatian kimia bukan organik formula li2Atau yang terbentuk bersama dengan sedikit lithium peroksida apabila logam litium dibakar di udara dan menggabungkan dengan oksigen.
Sehingga tahun 90 -an, pasaran logam dan litium dikuasai oleh pengeluaran AS dari deposit mineral, tetapi pada awal abad ke -21 kebanyakan pengeluaran diperoleh dari sumber lain: Australia, Chile dan Portugal adalah pembekal yang paling penting di dunia. Bolivia mempunyai separuh deposit litium di dunia, tetapi bukan pengeluar yang hebat.
Bentuk komersil yang paling penting ialah litium karbonat, li2Co3, Dihasilkan dari mineral atau salmuelas oleh beberapa proses yang berbeza.
Apabila litium terbakar di udara, produk utama adalah lithium oksida putih, LI2Sama ada. Di samping itu, beberapa lithium peroksida berlaku, LI2Sama ada2, Juga putih.
Ia juga boleh dilakukan melalui penguraian haba lithium hidroksida, liOH, atau lithium peroksida, LI2Sama ada2.
4Li (s) + o2(g) → 2li2Anda)
2Lioh (s) + panas → li2Atau (s) + h₂o (g)
2Li2Sama ada2(s) + panas → 2Li2Atau (s) + atau2(g)
Sifat fizikal dan kimia
- Lithium Oxide adalah pepejal putih yang dikenali sebagai lithia, yang tidak mempunyai aroma dan mempunyai rasa asin.
- Lithium oksida adalah kristal dengan geometri antiflorit, serupa dengan natrium klorida (padu berpusat pada wajah).
- Berat molekulnya adalah 29.88 g/mol, ketumpatannya adalah 2,013 g/ml dan titik gabungan dan mendidih masing -masing adalah 1438 ° C dan 2066 ° C,.
Ia dapat melayani anda: epid- Kompaun sangat larut dalam air, alkohol, eter, piridin dan nitrobenzene.
- Lithium oksida bertindak balas dengan mudah dengan wap air untuk membentuk hidroksida, dan karbon dioksida untuk membentuk karbonat; Oleh itu, ia mesti disimpan dan diuruskan dalam suasana yang bersih dan kering.
- Sebatian oksida tidak menjalankan elektrik. Walau bagaimanapun, oksida berstruktur perovskita adalah konduktif elektronik yang mencari aplikasi dalam katod sel bahan api pepejal dan sistem penjanaan oksigen.
- Mereka adalah sebatian yang mengandungi sekurang -kurangnya satu anion oksigen dan kation logam.
Risiko
Lithium Oxide adalah sebatian stabil yang tidak serasi dengan asid kuat, air dan karbon dioksida. Sejauh yang kita ketahui, sifat kimia, fizikal dan toksikologi litium oksida belum disiasat dan dilaporkan dengan teliti.
Ketoksikan sebatian litium adalah fungsi kelarutan mereka di dalam air. Ion lithium mempunyai ketoksikan dalam sistem saraf pusat. Kompaunnya sangat menghakis, menjengkelkan jika ia bersentuhan dengan mata dan kulit, apabila dihirup atau ditelan.
Sekiranya hubungan mata, anda mesti mengesahkan sama ada kanta lekap digunakan dan mengeluarkannya dengan segera. Mereka mesti dibilas dengan air yang mengalir selama sekurang -kurangnya 15 minit, menjaga kelopak mata terbuka. Air sejuk boleh digunakan, dan bukan salap mata.
Sekiranya bahan kimia bersentuhan dengan pakaian, simpannya secepat mungkin, melindungi tangan dan badannya sendiri. Letakkan mangsa di bawah mandi keselamatan.
Sekiranya bahan kimia berkumpul di kulit yang terdedah kepada mangsa, seperti tangan, kulit yang tercemar dengan air yang mengalir dan sabun yang tidak abrasive dibasuh dengan lembut dan berhati -hati. Air sejuk boleh digunakan. Sekiranya kerengsaan berterusan, dapatkan perhatian perubatan. Basuh pakaian yang tercemar sebelum menggunakannya lagi.
Boleh melayani anda: Skala Rankine: Apa, Penukaran, ContohSekiranya penyedutan, mangsa harus dibenarkan berdiri di kawasan pengudaraan yang baik. Sekiranya penyedutan itu serius, mangsa mesti dipindahkan ke kawasan yang selamat secepat mungkin.
Keluarkan pakaian yang ketat, seperti leher baju, tali pinggang atau tali leher. Sekiranya mangsa sukar bernafas, oksigen mesti diberikan. Sekiranya mangsa tidak bernafas, resusitasi mulut dibuat.
Sentiasa mengambil kira bahawa ia boleh berbahaya bagi orang yang memberikan bantuan untuk memberi mulut ke mulut ke mulut apabila bahan yang disedut adalah toksik, berjangkit atau mengakis. Dalam semua kes, perhatian perubatan segera harus dicari.
Aplikasi
- Lithium Oxide digunakan sebagai pengasas dalam enamel seramik, dan menghasilkan biru dengan tembaga dan mawar dengan kobalt. Bertindak balas dengan air dan stim, membentuk litium hidroksida dan harus diasingkan dari mereka.
- Lithium oksida (li2O), dengan potensi tritio yang tinggi, ia adalah calon yang menarik untuk bahan penanaman pepejal dari loji tenaga gabungan DT, disebabkan oleh ketumpatan tinggi atom litium (berbanding dengan litium lithium atau seramik litium logam) dan kekonduksian terma yang agak tinggi.
Li2O Ia akan terdedah kepada suhu tinggi di bawah penyinaran neutron semasa operasi selimut fusion. Dalam keadaan ini, sebilangan besar kecacatan penyinaran akan dihasilkan di LI2Atau, seperti pembengkakan yang disebabkan oleh helium, pengembangan haba yang agak tinggi, pertumbuhan bijirin, pembentukan dan pemendakan LYH (T) pada suhu rendah dan pengangkutan jisim LiOH (T) pada suhu tinggi.
Di samping itu, li2Atau akan tertakluk kepada ketegangan yang timbul daripada perbezaan pengembangan haba antara li2O dan bahan struktur. Ciri -ciri li ini2Atau membawa kepada masalah kejuruteraan yang mencabar baik dalam pembuatan dan dalam reka bentuk manta.
Boleh melayani anda: strontium hidrida (srh2)- Penggunaan baru yang mungkin seperti pengganti kobalt dan lithium oksida, seperti katod dalam bateri litium -ion yang digunakan untuk meningkatkan peranti telefon bimbit elektronik ke komputer riba, serta kereta dengan bateri.
Rujukan
- Elemen Amerika. Lithium oxide. Pulih dari americanements americanements.com.
- Lithium oxide. Pulih dari espimetal espimetals.com.
- Lithium Oxide (LI2O). FERP pulih.UCSD.Edu Ferp.UCSD.Edu.

