Aspek, Fungsi dan Contoh Umum Alosterisme

- 2322
- 401
- Miss Elmer Hagenes
Dia Alosterisme o Peraturan alostrika ditakrifkan sebagai proses perencatan atau pengaktifan enzim yang diantarkan oleh molekul pengawalseliaan yang berbeza dari substratnya dan bertindak dalam tapak tertentu strukturnya, berbeza dari tapak aktif yang sama.
Istilah "alosterik" atau "alosterisme" berasal dari akar Yunani "Allos ", yang bermaksud "yang lain" dan "Stereós", yang bermaksud "bentuk" atau "tempat"; Jadi secara literal diterjemahkan sebagai "ruang lain", "tempat lain" atau "struktur lain".
 Skim grafik A kepada Peraturan Teosterik. (A) laman web aktif. (B) Tapak alosterik. (C) substrat. (D) Inhibitor. (E) enzim. (Sumber: Isaac Webb [cc by-s (https: // creativeCommons.Org/lesen/by-sa/3.0)] melalui Wikimedia Commons)
Skim grafik A kepada Peraturan Teosterik. (A) laman web aktif. (B) Tapak alosterik. (C) substrat. (D) Inhibitor. (E) enzim. (Sumber: Isaac Webb [cc by-s (https: // creativeCommons.Org/lesen/by-sa/3.0)] melalui Wikimedia Commons) Sesetengah penulis menggambarkan alosterisme sebagai proses di mana tapak terpencil dalam sistem (struktur enzim, misalnya) secara bertenaga ditambah untuk menghasilkan tindak balas berfungsi, itulah sebabnya dapat diandaikan bahawa perubahan di rantau dapat mempengaruhi mana -mana dalam yang sama.
Peraturan jenis ini adalah tipikal enzim yang mengambil bahagian dalam pelbagai proses biologi yang diketahui, seperti transduksi isyarat, metabolisme (anabolisme dan katabolisme), peraturan ekspresi genetik, antara lain.
Idea pertama tentang alosterisme dan penyertaan mereka dalam mengawal metabolisme selular diumum pada tahun 1960 -an oleh F. Monod, f. Jacob dan J. Changeux, semasa mengkaji laluan biosintetik asid amino yang berbeza, yang dihalang selepas pengumpulan produk akhir.
Walaupun penerbitan pertama dalam hal ini berkaitan dengan peraturan genetik, masa yang singkat kemudian Monod, Wyman dan Changeux memperluaskan konsepsi alosterisme kepada protein dengan aktiviti enzimatik dan mencadangkan model berdasarkan protein multimerik, terutamanya disokong oleh interaksi antara subunit apabila ada ini menyertai effector.
Boleh melayani anda: guanina: ciri, struktur, latihan dan fungsiBanyak konsep berikutnya mempunyai asas mereka dalam teori "pelarasan teraruh" yang diperkenalkan oleh Koshland beberapa tahun sebelumnya.
[TOC]
Ciri-ciri umum
Secara umum, semua enzim mempunyai dua tapak yang berbeza untuk kesatuan ligan: satu dikenali sebagai tapak aktif, yang bergabung dengan molekul yang berfungsi sebagai substrat (bertanggungjawab untuk aktiviti biologi enzim), dan yang lainnya dikenali sebagai theosterik laman web, yang khusus untuk metabolit lain.
Ini "metabolit lain" dipanggil effectors alestheric dan boleh memberi kesan positif atau negatif terhadap kelajuan tindak balas yang dipangkin oleh enzim atau dalam pertalian yang mereka sertai substrat mereka di tapak aktif.
Biasanya, kesatuan effector di AL, tapak enzim menyebabkan kesan di tapak lain struktur, mengubah aktiviti atau prestasi fungsinya.
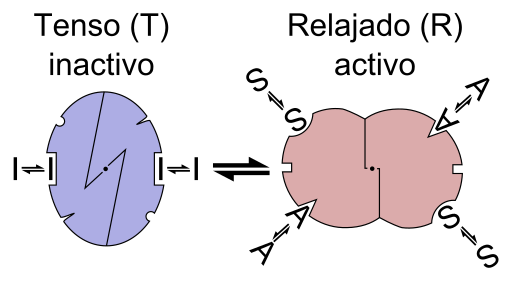 Skim grafik reaksi enzim alosterica (Sumber: Fail: Enzyme Allostery adalah.PNG: Fail: Enzyme Allostery.PNG: Allostery.PNG: Nicolas Le Novere (bercakap).Lenov di.Wikipediaderivative Work: Timvickers (Talk) Derivative Work: Retama (Talk) Derivative Work: KES47 [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) melalui Wikimedia Commons)
Skim grafik reaksi enzim alosterica (Sumber: Fail: Enzyme Allostery adalah.PNG: Fail: Enzyme Allostery.PNG: Allostery.PNG: Nicolas Le Novere (bercakap).Lenov di.Wikipediaderivative Work: Timvickers (Talk) Derivative Work: Retama (Talk) Derivative Work: KES47 [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) melalui Wikimedia Commons) Dalam erti kata lain, kesatuan effector alestro ke tempat tertentu dalam struktur enzim menyebabkan perubahan dalam geometri molekul enzim, yang dikenali sebagai peralihan kepada teosterik, iaitu, ia adalah peristiwa yang dihantar Sepanjang makromolekul, mengubah tingkah lakunya.
Alosterisme boleh menjadi homotropik atau heterotropik. Proses peraturan alostroik homotropik ditakrifkan sebagai satu di mana substrat enzim yang sama bertindak sebagai pengatur alestriknya, iaitu, effector alosterik adalah substrat yang sama; Ia juga dikenali sebagai jenis koperasi.
Proses peraturan heterotropik, sebaliknya, merujuk kepada peraturan aktiviti enzim yang diantarkan oleh molekul atau effector theosteric yang berbeza dari substratnya, dan juga mempunyai kesan positif atau negatif terhadap aktiviti enzim.
Ia boleh melayani anda: Aptenia Cordifolia: Ciri -ciri, Habitat, Hartanah, PenanamanFungsi
Alosterisme, bersama -sama dengan peraturan ekspresi genetik, terjemahan, dan kemerosotan protein, adalah salah satu mekanisme asas bagi pengawalan sejumlah besar proses organik, yang penting untuk penyelenggaraan homeostasis dan untuk bertahan hidup semua hidup, uniselular atau multiselular makhluk.
Peraturan toostal atau alosterisme memberikan organisma hidup keupayaan untuk bertindak balas dengan sensitiviti yang besar terhadap perubahan kepekatan ligan pengawalseliaan, serta fenomena berirama yang berasal dari tahap selular.
Oleh kerana substrat tenaga dan metabolik terhingga dalam sel, alosterisme membolehkan, dalam bidang metabolik, penggunaan sumber yang sederhana, mengelakkan kedua -dua kitaran yang tidak berguna dan pembaziran tenaga untuk pemprosesan substrat yang berlebihan dalam keadaan kelimpahan atau kekurangan.
Begitu juga, mekanisme peraturan ini sangat penting untuk proses isyarat sel, di mana banyak perubahan konformasi yang dicetuskan oleh kesatuan ligan yang berbeza di tapak tertentu reseptor yang dipersoalkan.
Contoh Alosterisme
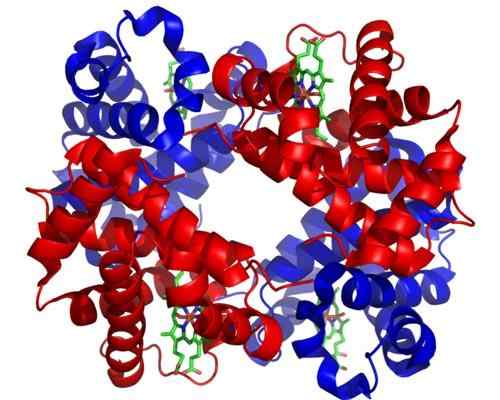 Hemoglobin. Diambil dan diedit dari: Zephyris di bahasa Inggeris Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]].
Hemoglobin. Diambil dan diedit dari: Zephyris di bahasa Inggeris Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Walaupun terdapat beribu -ribu contoh toosterisme atau peraturan di alam semula jadi, ada yang lebih menonjol daripada yang lain. Begitulah kes hemoglobin, yang merupakan salah satu protein pertama yang diterangkan secara mendalam dalam aspek struktur.
Hemoglobin adalah protein yang sangat penting bagi banyak haiwan, kerana ia bertanggungjawab untuk pengangkutan oksigen melalui darah dari paru -paru ke tisu. Protein ini membentangkan homotropik dan heterotropik kepada peraturan theosterik pada masa yang sama.
Boleh melayani anda: Saltacionisme: Ciri -ciri, Bukti dan ContohAlosterisme homotropik hemoglobin ada kaitan dengan kesatuan molekul oksigen ke salah satu subunit yang membentuknya secara langsung mempengaruhi pertalian yang subunit bersebelahan dengan molekul oksigen yang lain mengikat, meningkatkannya (peraturan positif atau koperasi).
Heterotropik ke heterotropik
Alosterisme heterotropik, sebaliknya, berkaitan dengan kesan kedua.
Transcarbamilase atau Atcasa Aspartate, yang mengambil bahagian dalam laluan sintesis pyrimidine, juga merupakan salah satu contoh "klasik" peraturan alosterik. Enzim ini, yang mempunyai 12 subunit, di mana 6 aktif secara aktif dan 6 adalah pengawal selia, dihalang secara heterotropik oleh produk akhir laluan yang mengetuai, cytidininatrifosphate (CTP).
Operon laktosa Dan. coli
Buah idea pertama monod, Jacob dan Changeaux adalah artikel yang diterbitkan oleh Jacob dan Monod yang berkaitan dengan laktosa laktosa laktosa Escherichia coliYo, yang merupakan salah satu contoh peraturan heterotropik ke peringkat genetik.
Peraturan toostal sistem ini tidak berkaitan dengan keupayaan untuk menukar substrat ke dalam produk, tetapi kepada pertalian kesatuan protein ke rantau DNA operasi.
Rujukan
- Changeux, J. P., & Edelstein, s. J. (2005). Mekanisme allosteric transduksi isyarat. Sains, 308 (5727), 1424-1428.
- Goldbeter, a., & Dupont, g. (1990). Peraturan allosteric, kerjasama, dan ayunan biokimia. Kimia Biophysical, 37 (1-3), 341-353.
- Jiao, w., & Parker, dan. J. (2012). Menggunakan pengkomputeran teknik pengiraan dan eksperimen untuk memahami asas molekul untuk protein allostery. Dalam Kemajuan dalam Kimia Protein dan Biologi Struktur (Vol. 87, ms. 391-413). Akhbar Akademik.
- Kern, d., & Zuiderweg, dan. R. (2003). Peranan dinamik dalam peraturan allosteric. Pendapat Semasa dalam Biologi Struktur, 13 (6), 748-757.
- Laskowski, r. Ke., Gerick, f., & Thornton, J. M. (2009). Asas struktur peraturan allosteric dalam protein. Surat FEBS, 583 (11), 1692-1698.
- Mathews, c. K., Van holde, k. Dan., & Ahern, k. G. (2000). Biokimia, ed. San Francisco, Calif.

