Amphoters, jenis dan contoh
- 1471
- 217
- Mr. Tracy Parisian
The Amphostters Mereka adalah sebatian atau ion yang mempunyai keanehan dapat berkelakuan sebagai asid atau sebagai pangkalan, menurut teori Bronsted dan Lowry. Namanya berasal dari perkataan Yunani Amphoteroi, yang bermaksud "kedua -duanya".
Banyak logam membentuk amphoteros oksida atau hidroksida, termasuk tembaga, zink, timah, plumbum, aluminium dan berilium. Ciri amphoter oksida ini bergantung kepada keadaan pengoksidaan oksida yang dipersoalkan. Pada akhir contoh artikel bahan -bahan ini dimasukkan.

Oksida logam yang boleh bertindak balas dengan asid dan asas untuk menghasilkan garam dan air dikenali sebagai amphoteros oksida. Oksida plumbum dan zink adalah contoh yang sangat baik, antara sebatian lain.
[TOC]
Apa itu amphoter?
Menurut teori asid-asas Bronsted dan Lowry, asid adalah bahan-bahan yang mendermakan proton, sementara pangkalannya adalah yang menerima atau mengambil proton.
Molekul yang dipanggil amphotate akan mempunyai reaksi di mana ia memperoleh proton, kerana ia juga akan mempunyai keupayaan untuk mendermakannya (walaupun tidak selalu begitu, seperti yang akan dilihat di bahagian seterusnya).
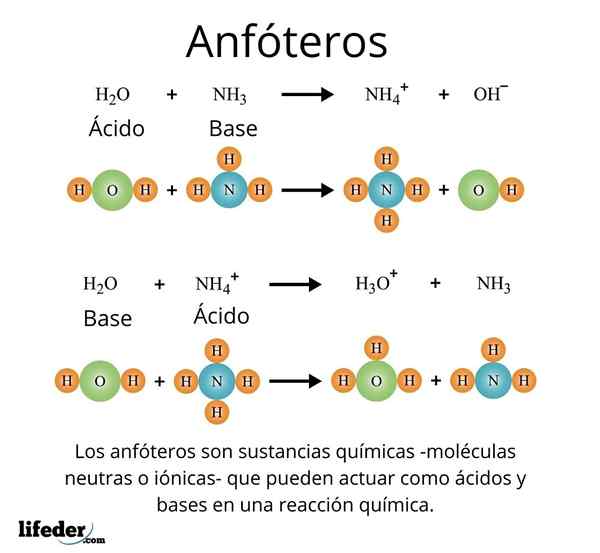
Kes yang penting dan baik adalah pelarut sejagat, air (h₂o). Bahan ini bertindak balas dengan mudah dengan asid, sebagai contoh, sebagai tindak balas dengan asid hidroklorik:
H2O + HCl → H3Sama ada+ + Cl-
Tetapi pada gilirannya, dia juga tidak mempunyai masalah yang bertindak balas dengan asas, seperti dalam hal ammonia:
H2O + NH3 → NH4 + Oh-
Dengan contoh -contoh ini dapat diperhatikan bahawa air bertindak sepenuhnya sebagai bahan amphotate.
Jenis Amphoters
Walaupun bahan amphotent boleh menjadi molekul atau ion, terdapat molekul yang paling baik menunjukkan ciri -ciri amphotent dan membantu untuk mengkaji tingkah laku ini dengan lebih baik: bahan amphrophrotik. Ini adalah molekul yang secara khusus boleh menderma atau menerima proton untuk bertindak sebagai asid atau asas.
Boleh melayani anda: rodio: sejarah, sifat, struktur, kegunaan, risikoIa harus dijelaskan bahawa semua bahan amphotik adalah amphotik, tetapi tidak semua amphoter adalah amphiprtic; Ada amphotoros yang tidak mempunyai proton, tetapi mereka boleh berkelakuan sebagai asid atau pangkalan dengan cara lain (seperti teori Lewis).
Antara bahan amphiprtik adalah air, asid amino dan ion bikarbonat dan sulfat. Sebaliknya, bahan amphrophotic juga subclassified mengikut keupayaan mereka untuk menderma atau menghasilkan proton:
Bahan asid protogenik atau amphiprytic
Adalah mereka yang mempunyai kecenderungan yang lebih besar untuk memberikan proton daripada menerima satu. Antaranya ialah asid sulfurik (h2SW4) dan asid asetik (CHO3Cooh), antara lain.
Bahan protofilik atau amphotik asas
Mereka adalah mereka yang menerima proton lebih biasa daripada menghasilkannya. Antara bahan ini anda dapat mencari ammonia (NH3) dan etilendiamida [c2H4(NH2)2].
Bahan neutral
Mereka mempunyai kemudahan atau kemampuan yang sama untuk menerima proton untuk menyerahkannya. Antaranya adalah air (h2O) dan alkohol kecil (-roh), terutamanya.
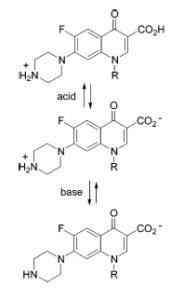 Ampotero watak quinolones
Ampotero watak quinolones Contoh bahan amphotent
 Ketegangan amphotero
Ketegangan amphotero Sekarang, anda sudah menerangkan bahan amphotent yang diperlukan untuk menunjukkan contoh reaksi di mana ciri -ciri ini dibentangkan.
Ion asid karbonik membentangkan kes asas bahan amphiprtic; Kemudian reaksi mereka diwakili apabila ia bertindak sebagai asid:
HCO3- + Oh- → Co32- + H2Sama ada
Reaksi seterusnya berlaku apabila ia bertindak sebagai asas:
HCO3- + H3Sama ada+ → h2Co3
Terdapat juga banyak bahan lain. Dari ini adalah contoh berikut:
Amphoteros oksida
Zink oksida, seperti yang telah disebutkan, adalah amphotero tetapi bukan bahan amphiprtik. Seterusnya, ia menunjukkan mengapa.
Boleh melayani anda: Justus von LiebigBerkelakuan sebagai asid:
ZnO + H2SW4 → ZnSO4 + H2Sama ada
Berkelakuan sebagai pangkalan:
ZnO + 2NAOH + H2O → na2[Zn (OH)4]
Lead Oxide (PBO), Aluminium (AL2Sama ada3) dan timah (sno) juga mempunyai ciri -ciri amphotent mereka sendiri:
Berkelakuan seperti asid:
PBO + 2HCL → PBCL2 + H2Sama ada
Kepada2Sama ada3 + 6HCl → 2Alcl3 + 3h2Sama ada
Sno + hcl ↔ sncl + h2Sama ada
Dan sebagai pangkalan:
PBO + 2NAOH + H2O → na2[PB (OH)4]
Kepada2Sama ada3 + 2NAOH + 3H2O → 2NA [Al (oh)4]
Sno + 4NaOH + h2Atau ↔ na4[Sn (oh)6]
Terdapat juga amphoteros oksida dari Gaul, India, Scandio, Titanium, Circonium, Vanadium, Chrome, Besi, Kobalt, Tembaga, Perak, Emas, Jermanio, Antimoni, Bismut dan telurio.
Anfoter Hydroxides
Hidroksida juga boleh membentangkan ciri -ciri amphotent, seperti dalam kes -kes aluminium hidroksida dan berilium. Kedua -dua contoh diperhatikan di bawah:
Aluminium hidroksida sebagai asid:
Al (oh)3 + 3HCl → Alcl3 + 3h2Sama ada
Aluminium hidroksida sebagai asas:
Al (oh)3 + NaOH → Na [Al (oh)4]
Beryllium hidroksida sebagai asid:
Jadilah (oh)2 + 2HCl → Becl2 + H2Sama ada
Beryllium hidroksida sebagai asas:
Jadilah (oh)2 + 2NAOH → NA2[Jadilah (oh)4]
Perbezaan antara amphoteros, amphiprtic, ampholites dan apraticics
Adalah perlu untuk mengetahui bagaimana membezakan konsep setiap istilah, kerana persamaannya dapat menjadi mengelirukan.
Diketahui bahawa amphotoros adalah bahan yang berkelakuan seperti asid atau pangkalan dalam tindak balas yang menghasilkan garam dan air. Mereka boleh melakukan ini untuk sumbangan atau penangkapan proton, atau hanya dengan menerima tork elektronik (atau memberikannya) mengikut teori Lewis.
Sebaliknya, bahan amphotik adalah amphoter yang bertindak sebagai asid atau asas dengan sumbangan atau pengumpulan proton, menurut undang-undang Bronsted-lowry. Semua bahan amphotik adalah amphotik.
Boleh melayani anda: benzoin: struktur, sifat, kegunaan dan risikoSebatian ampolitik adalah molekul amphotent yang wujud sebagai zwitterions dan mempunyai ion dipole di phyes tertentu pH. Mereka digunakan sebagai agen redaman dalam penyelesaian penampan.
Akhirnya, pelarut memerah adalah mereka yang tidak mempunyai proton untuk memberi dan tidak dapat menerimanya sama ada.
Rujukan
- Amphoteric. (2008). Wikipedia. Diperoleh dari dalam.Wikipedia.org
- Anne Marie Helmestine, p. (2017). Apa maksud amphoterik dalam kimia?. Diperoleh dari pemikiran.com
- Bicpuc. (2016). Sebatian amphoterik. Diperoleh dari medum.com
- Chemicool. (s.F.). Definisi amphoterik. Diperoleh dari chemicool.com.
- « Kolombia biasa yang paling popular
- Pilihan topik penyelidikan bagaimana, kepentingan, contoh dilakukan »

