Anhydrides

- 3792
- 699
- Ms. Micheal Rippin
Apa itu anhydrides?
The Anhydrides Mereka adalah sebatian kimia yang berasal dari kesatuan dua molekul dengan pembebasan air. Oleh itu, ia dapat dilihat sebagai dehidrasi bahan -bahan awal; Walaupun ia tidak tepat.
Dalam kimia organik dan bukan organik, mereka disebutkan, dan di kedua -dua cawangan pemahaman mereka berbeza dengan tahap yang cukup tinggi. Sebagai contoh, dalam kimia bukan organik dianggap asas dan asid oksida seperti anhidri masing -masing hidroksida dan asid masing -masing, kerana bekas bertindak balas dengan air untuk membentuk yang kedua.
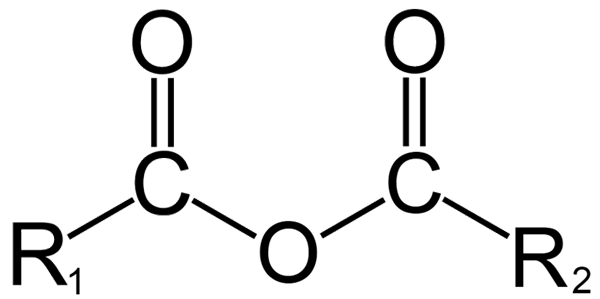 Struktur umum anhydrides. Sumber: Dremmetbrownie [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], dari Wikimedia Commons
Struktur umum anhydrides. Sumber: Dremmetbrownie [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], dari Wikimedia Commons Di sini kekeliruan antara istilah 'anhydrous' dan 'anhydrido' dapat dihasilkan. Secara amnya, anhydrous merujuk kepada sebatian yang telah dehidrasi tanpa perubahan dalam sifat kimianya (tidak ada reaksi); Walaupun dengan anhidrida, terdapat perubahan kimia, ditunjukkan dalam struktur molekul.
Sekiranya hidroksida dan asid yang sepadan (atau anhidrida) dibandingkan, ia akan diperhatikan bahawa terdapat tindak balas. Sebaliknya, sesetengah oksida atau garam boleh terhidrasi, kehilangan air, dan terus menjadi sebatian yang sama; Tetapi, tanpa air, iaitu, anhydros.
Dalam kimia organik, sebaliknya, apa yang difahami oleh anhydride adalah definisi awal. Sebagai contoh, salah satu anhydrides yang paling terkenal adalah yang berasal dari asid karboksilik (imej unggul). Ini terdiri daripada kesatuan dua kumpulan acil (-RCO) melalui atom oksigen.
Dalam struktur umum, r ditunjukkan1 Untuk kumpulan acyl, dan r2 Untuk kumpulan acilo kedua. Kerana r1 dan r2 Mereka berbeza, berasal dari asid karboksilik yang berbeza dan kemudian ia adalah asid asimetrik anhydride. Apabila kedua -dua substituen r (sama ada aromatik) adalah sama, ada ceramah dalam kes anhidrida asid simetri.
Pada masa menghubungkan dua asid karboksilik untuk membentuk anhidrida, air boleh atau tidak terbentuk, serta sebatian lain. Semuanya bergantung pada struktur asid ini.
Sifat anhydrid
Sifat -sifat anhydrides bergantung kepada mana yang dirujuk. Hampir semua orang mempunyai persamaan bahawa mereka bertindak balas dengan air. Walau bagaimanapun, untuk anhydrides asas yang dipanggil dalam bukan organik, beberapa daripada mereka bahkan tidak larut dalam air (MGO), jadi pernyataan ini akan memberi tumpuan kepada anhydrids asid karboksilik.
Titik gabungan dan mendidih jatuh pada struktur molekul dan interaksi intermolecular untuk (RCO)2Atau, ini menjadi formula kimia umum sebatian organik ini.
Sekiranya jisim molekul (RCO)2Atau rendah, mungkin cecair tidak berwarna pada suhu bilik dan tekanan. Sebagai contoh, anhydride asetik (atau ehydridge3Co)2Atau, ia adalah cecair dan kepentingan industri yang paling penting, pengeluarannya sangat luas.
Reaksi antara anhidrida dan air asetik diwakili oleh persamaan kimia berikut:
(Ch3Co)2Atau + h2O => 2ch3COOH
Perhatikan bahawa apabila molekul air ditambah, dua molekul asid asetik dilepaskan. Reaksi terbalik, bagaimanapun, tidak boleh berlaku untuk asid asetik:
Boleh melayani anda: baki wap cecair2ch3COOH => (CHO3Co)2Atau + h2Atau (tidak berlaku)
Adalah perlu untuk menggunakan laluan sintetik yang lain. Asid dicarboxylic, sebaliknya, boleh melakukannya dengan pemanasan; Tetapi ia akan dijelaskan di bahagian seterusnya.
Tindak balas kimia
Hydrolysis
Salah satu reaksi paling mudah anhydrides adalah hidrolisis mereka, yang baru ditunjukkan untuk anhidrida asetik. Sebagai tambahan kepada contoh ini, terdapat anhidrida asid sulfurik:
H2S2Sama ada7 + H2Atau 2h2SW4
Di sini anda mempunyai anhidrida asid bukan organik. Perhatikan bahawa untuk h2S2Sama ada7 (Juga dipanggil asid disulfurik), tindak balas boleh diterbalikkan, jadi pemanasan h2SW4 Berkonsentrasi menghasilkan pembentukan anhidrida. Jika, sebaliknya, ia adalah penyelesaian c yang dicairkan H2SW4, Ia dibebaskan begitu3, Sulfurik anhydride.
Esterifikasi
Anhydrides asid bertindak balas dengan alkohol, dengan piridin di tengah, untuk menimbulkan ester dan asid karboksilik. Sebagai contoh, tindak balas antara anhidrida asetik dan etanol dianggap:
(Ch3Co)2Atau + ch3Ch2Oh => cho3Co2Ch2Ch3 + Ch3COOH
Dengan itu membentuk ester etil etan, CH3Co2Ch2Ch3, dan asid etana (asid asetik).
Secara praktikal, apa yang berlaku ialah penggantian hidrogen kumpulan hidroksil, oleh kumpulan Aquilus:
R1-Oh => r1-Ocor2
Dalam kes (ch3Co)2Atau, kumpulan acilo anda adalah -coch3. Oleh itu, dikatakan bahawa kumpulan OH sedang menjalani acilasi. Walau bagaimanapun, acilasi dan esterifikasi bukan konsep yang boleh ditukar ganti; Acilation boleh berlaku secara langsung dalam cincin aromatik, yang dikenali sebagai nama acily friedel.
Oleh itu, alkohol dengan kehadiran anhidrida asid diasingkan oleh acilasi.
Sebaliknya, hanya satu daripada dua kumpulan asid bereaksi dengan alkohol, yang lain tetap dengan hidrogen membentuk asid karboksilik; bahawa dalam kes (CHO3Co)2Atau, ia adalah asid etanoik.
Pengaruh
Asid anhydrides bertindak balas dengan ammonia atau amina (primer dan menengah), untuk menimbulkan amida. Reaksi ini sangat mirip dengan esterifikasi yang baru diterangkan, tetapi ROH digantikan oleh amina; Sebagai contoh, amina sekunder, r2NH.
Sekali lagi, tindak balas antara (ch3Co)2Atau dan diethylamine, et2NH:
(Ch3Co)2O + 2et2Nh => ch3Cont2 + Ch3COO- +NH2Et2
Dan diethilacetamide terbentuk, cho3Cont2, dan garam ammonium karboksilat, CHO3COO- +NH2Et2.
Walaupun persamaan mungkin agak sukar difahami, sudah cukup untuk memerhatikan bagaimana kumpulan -coch3 ganti H dari ET2NH untuk membentuk amida:
Et2Nh => et2NCOCH3
Lebih dari sekadar amidasi, tindak balas masih acilasi. Segala -galanya diringkaskan dalam perkataan itu; Kali ini, Amina menderita dan bukan alkohol.
Bagaimana anhydrides?
Anhydrides bukan organik dibentuk dengan bertindak balas dengan elemen dengan oksigen. Oleh itu, jika elemen itu logam, oksida logam asas terbentuk; Dan jika ia bukan -logam, anhidrida oksida atau asid bukan metallic terbentuk.
Ia dapat melayani anda: Persamaan Clausius-Clapeyron: Apa itu, Contoh, LatihanUntuk anhydrides organik, tindak balas adalah yang lain. Dua asid karboksilik tidak boleh bergabung secara langsung untuk melepaskan air dan membentuk asid anhydride; Penyertaan sebatian yang belum disebutkan: acyl chloride, RCOCL diperlukan.
Asid karboksilik bertindak balas dengan asid klorida, menghasilkan anhidrida dan hidrogen klorida masing -masing:
R1Cocl + R2COOH => (r1Co) atau (cor2) + HCl
Ch3COCL + CH3COOH => (CHO3Co)2O + HCl
A ch3 berasal dari kumpulan asetil, CHO3Bersama, dan yang lain sudah ada dalam asid asetik. Pilihan asid klorida tertentu, serta asid karboksilik, boleh menimbulkan sintesis anhydride asid simetri atau asimetrik.
Anhydrides kitaran
Tidak seperti asid karboksilik lain yang memerlukan asid klorida, asid dicarboxylic boleh memeluk dalam anhidrida yang sepadan. Untuk melakukan ini, perlu memanaskan mereka untuk mempromosikan pembebasan H2Sama ada. Contohnya, pembentukan anhidrida phthalic ditunjukkan dari asid photal.
 Pembentukan anhydride fthalical. Sumber: Jü [Domain Awam], dari Wikimedia Commons
Pembentukan anhydride fthalical. Sumber: Jü [Domain Awam], dari Wikimedia Commons Perhatikan bagaimana cincin pentagonal selesai, dan oksigen yang menyertai kedua -dua kumpulan c = o adalah sebahagian daripadanya; Ini adalah anhydride kitaran. Ia juga dapat dilihat bahawa anhydride phthalic adalah anhydride simetri, kerana begitu banyak r r1 seperti r2 Mereka sama: cincin aromatik.
Tidak semua asid dicarboxylic dapat membentuk anhidrida mereka, kerana ketika kumpulan COOH mereka sangat terpisah, mereka terpaksa menyelesaikan cincin yang semakin besar. Cincin terbesar yang boleh dibentuk adalah heksagon, lebih besar daripada reaksi yang tidak berlaku.
Nomenclature
Bagaimana anhydrides dinamakan? Mengetepikan bukan organik, berkaitan dengan isu oksida, nama -nama anhydrid organik sejauh ini menjelaskan bergantung kepada identiti r r1 dan r2; iaitu, kumpulan acylnya.
Jika kedua -kedua adalah sama, sudah cukup untuk menggantikan perkataan 'asid' dengan 'anhydrid' dalam nama asid karboksilik masing -masing. Dan jika, sebaliknya, kedua -dua r adalah berbeza, mereka dinamakan mengikut urutan abjad. Oleh itu, untuk mengetahui cara memanggilnya, anda perlu melihat terlebih dahulu jika ia adalah anhydride simetri atau asimetrik.
Ch3Co)2Atau ia simetri, kerana r1= R2 = Ch3. Ia berasal dari asid asetik atau etanoik, jadi namanya, mengikuti penjelasan sebelumnya: anhidrida asetik atau etano. Perkara yang sama berlaku dengan anhydride fthalic yang baru disebutkan.
Katakan anda mempunyai anhydride berikut:
Ch3CO (O) COCH2Ch2Ch2Ch2Ch2Ch3
Kumpulan asetil di sebelah kiri berasal dari asid asetik, dan di sebelah kanan, dari asid heptanoik. Untuk menamakan anhydride ini, anda mesti melantik kumpulan R dalam susunan abjad. Jadi, namanya ialah: anhidrida asetik heptanoik.
Aplikasi
Anhydrides bukan organik mempunyai aplikasi yang tidak berkesudahan, dari sintesis dan perumusan bahan, seramik, pemangkin, simen, elektrod, baja, dll., Sehingga sebagai salutan kerak bumi dengan beribu -ribu mineral besi dan aluminium, dan karbon dioksida dihiasi oleh organisma hidup.
Boleh melayani anda: penyingkiran: konsep, contoh dan jenisMereka mewakili sumber permulaan, titik di mana banyak sebatian yang digunakan dalam sintesis bukan organik diperoleh. Salah satu anhydrides yang paling penting ialah Carbonic, CO2. Ia bersama -sama dengan air, penting untuk fotosintesis. Dan di peringkat perindustrian, SO3 Sangat penting kerana asid sulfurik terdakwa diperoleh daripadanya.
Mungkin, anhydride dengan lebih banyak aplikasi dan untuk mempunyai (selagi ada kehidupan) adalah satu dari asid fosforik: adenosine tryposphate, lebih dikenali sebagai ATP, hadir dalam DNA dan "mata wang tenaga" metabolisme.
Anhydrides organik
Anhydrides Asid bertindak balas melalui acilasi, sama ada kepada alkohol, membentuk ester, amina, yang menimbulkan amida, atau cincin aromatik.
Terdapat berjuta -juta sebatian ini, dan beratus -ratus ribu pilihan asid karboksilik untuk menyediakan anhidrida; Oleh itu, kemungkinan sintetik berkembang secara drastik.
Oleh itu, salah satu aplikasi utama adalah menggabungkan kumpulan asid ke dalam sebatian, menggantikan salah satu atom atau kumpulan strukturnya.
Setiap dioksida secara berasingan mempunyai aplikasi sendiri, tetapi secara umum mereka semua bertindak dengan cara yang sama. Atas sebab itu, jenis sebatian ini digunakan untuk mengubah struktur polimer, mewujudkan polimer baru; Iaitu, kopolimer, resin, salutan, dll.
Contohnya, anhidrida asetik digunakan untuk mengasingkan semua kumpulan OH selulosa (imej yang lebih rendah). Dengan ini, setiap h OH digantikan oleh kumpulan asetil, COCH3.
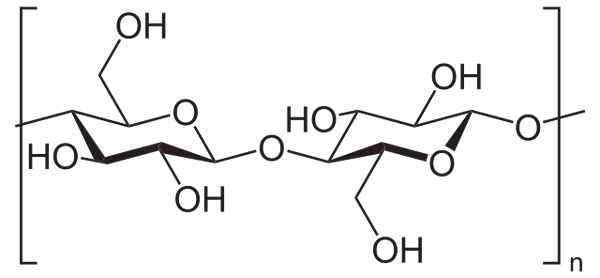 Selulosa. Sumber: Neurotoger [Domain Awam], dari Wikimedia Commons
Selulosa. Sumber: Neurotoger [Domain Awam], dari Wikimedia Commons Dengan cara ini polimer selulosa asetat diperoleh. Reaksi yang sama boleh dilukis dengan struktur polimer lain dengan kumpulan NH2, Juga terdedah kepada acilasi.
Reaksi penyisihan ini juga berguna untuk sintesis dadah, seperti aspirin (asid asetilsalisili).
Contoh
Mereka ditunjukkan untuk menyelesaikan beberapa contoh lain dari anhidri organik. Walaupun mereka tidak akan menyebutnya, atom oksigen dapat digantikan oleh sulfur, memberikan anhydrides sulfur, atau bahkan fosforus.
-C6H5Co (o) masak6H5: Benzoic anhydride. Kumpulan c6H5 mewakili cincin benzena. Hidrolisisnya menghasilkan dua asid benzoik.
-HCO (O) COH: Formik Anhydrid. Hidrolisisnya menghasilkan dua asid formik.
- C6H5CO (O) COCH2Ch3: Anhydride benzoik propanoik. Hidrolisisnya menghasilkan asid benzoik dan propanik.
-C6HsebelasCo (o) masak6Hsebelas: Cyclohexanocroboxylicanight anhydrid. Tidak seperti cincin aromatik, ini tepu, tanpa pautan berganda.
-Ch3Ch2Ch2CO (O) COCH2Ch3: Anhydride propanoic.
Anhydride succinic
 Anhydride succinic. Sumber: Ninjatacoshell [Domain Awam], dari Wikimedia Commons
Anhydride succinic. Sumber: Ninjatacoshell [Domain Awam], dari Wikimedia Commons Di sini anda mempunyai kitaran lain, yang berasal dari asid succinic, asid dicarboxylic. Perhatikan seperti tiga atom oksigen yang mengkhianati sifat kimia jenis ini.
Maleico anhydride sangat mirip dengan succinic, dengan perbezaan bahawa terdapat ikatan ganda antara karbon yang membentuk pangkalan pentagon.
Anhydride glutarian
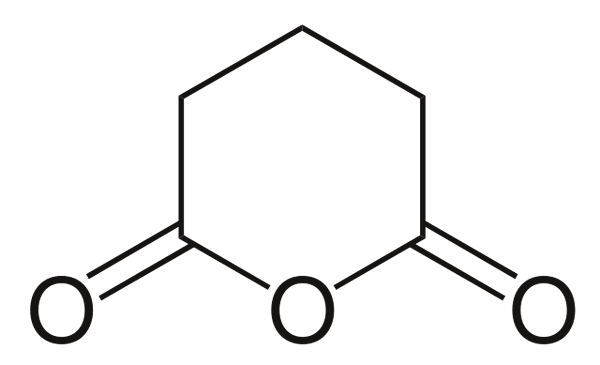 Anhydride glutarian. Sumber: Choij [Domain Awam], dari Wikimedia Commons
Anhydride glutarian. Sumber: Choij [Domain Awam], dari Wikimedia Commons Dan akhirnya anhidrida asid glutaric ditunjukkan. Ini secara struktural membezakan semua yang lain dengan terdiri daripada cincin heksagon. Sekali lagi, tiga atom oksigen menonjol dalam struktur.
Anhidrida lain yang lebih kompleks selalu dapat dibuktikan oleh tiga atom oksigen yang sangat dekat antara satu sama lain.
Rujukan
- Anhydride. Enclyclopaedia Britannica. Pulih dari: Britannica.com
- Definisi Anhydride Asid dalam Kimia. Pulih dari: Thoughtco.com

