Mengimbangi persamaan kimia
- 3414
- 182
- Erick Krajcik
Apakah pengimbangan persamaan kimia?
Pengimbangan persamaan kimia adalah operasi matematik yang dijalankan untuk mengekalkan undang -undang pemuliharaan bahan dalam reaksi. Perkara tidak dibuat atau dimusnahkan. Oleh itu, bilangan atom sebelum dan selepas tindak balas kimia mestilah sama, baik dalam reagen dan dalam produk.
Untuk mengimbangkan persamaan kimia, anda harus mengira atom sebelum dan selepas anak panah. Sekiranya angka bertepatan, ini bermakna tindak balas itu seimbang. Jika tidak, perlu dipadankan.
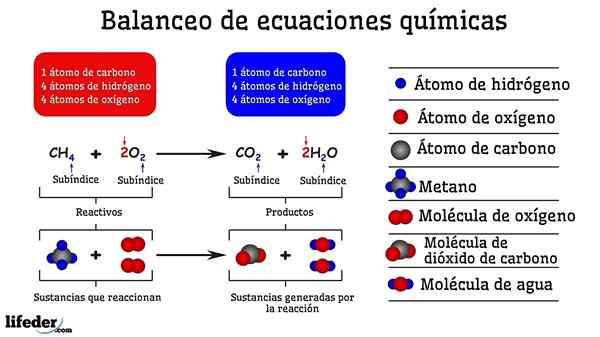
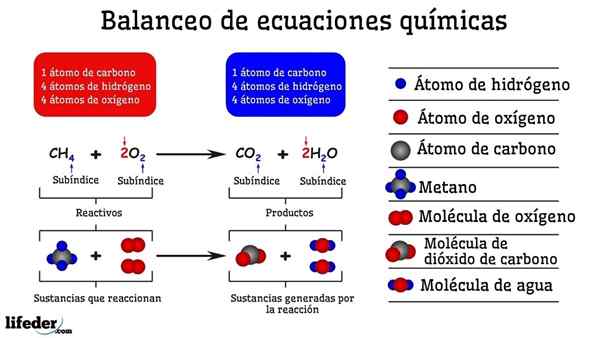 Contoh pengimbangan kimia tindak balas antara metana dan dua molekul oksigen
Contoh pengimbangan kimia tindak balas antara metana dan dua molekul oksigen Apabila ia seimbang dengan percubaan dan kesilapan, seolah -olah mereka telah dikeluarkan atau menambah atom di salah satu daripada kedua -dua belah subbaja. Sehingga Subbaja tidak digantung secara mendatar, persamaan kimia tidak akan seimbang sepenuhnya. Tidak ada lagi (membuat bahan) atau kurang atom (memusnahkan bahan) di mana -mana sisi.
Contoh persamaan mengimbangi mudah
Dalam contoh berikut, anda akan melihat seimbang atau mudah untuk mengimbangi persamaan kimia. Semua mesti mempunyai persamaan bahawa bilangan atom, untuk setiap elemen, akan sama sebelum dan selepas anak panah apabila persamaan kimia telah seimbang.
Pengoksidaan Merkuri
2Hg +o2 → Hg2Sama ada2
Kami mempunyai dua elemen: merkuri (HG) dan oksigen (O). Kami menyatakan bilangan atom mereka sebelum (reagen) dan kemudian (produk) anak panah:
HG: 2 (kiri) - 2 (kanan)
Ia boleh melayani anda: pecahan molar: bagaimana ia dikira, contoh, latihanO: 2 (kiri) - 2 (kanan)
Persamaannya seimbang kerana atom Hg dan atau sama di kedua -dua belah anak panah.
Pembakaran hidrogen
H2 + Sama ada2 → h2Sama ada
Kami mempunyai dua elemen lagi: hidrogen (h) dan oksigen (o). Mengulangi langkah sebelumnya:
H: 2 - 2
O: 2 - 1
Di sebelah kiri terdapat oksigen lebih daripada di sebelah kanan. Oleh itu, kita mesti menambah oksigen yang betul. Untuk melakukan ini, kami mengubahsuai pekali stoikiometrik, yang merupakan nombor yang mengiringi dan mendahului formula. Sekiranya kita meletakkan 2 di hadapan h2Atau akan memberi kita:
H2 + Sama ada2 → 2h2Sama ada
H: 2 - 4
O: 2 - 2
Oksigen seimbang. Tetapi bukan hidrogen. Anda mesti menambah dua hidrogen sekarang ke kiri:
2h2 + Sama ada2 → 2h2Sama ada
H: 4 - 4
O: 2 - 2
Dan persamaan akhirnya seimbang: bilangan h dan sebelum dan selepas anak panah yang sama.
Perhatikan bahawa pekali stoikiometrik (2 untuk h2 dan 1 untuk O2) melipatgandakan subskrip formula. Pendaraban ini akan memberi kita jumlah atom untuk elemen tertentu.
Pengurangan magnesium
Mg (no3)2 + 2Li → mg +2lino3
Kami menilai nombor atom untuk setiap elemen:
MG: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
Persamaan kimia sudah seimbang dan tidak perlu mengimbanginya.
Latihan yang diselesaikan
Sebelum meneruskan untuk mengimbangi sebarang persamaan, selalu perlu untuk mengesahkan jika tidak lagi seimbang. Yang berkata, kami meneruskan latihan berikut:
Latihan 1
Seimbang atau tidak?
Iman2Sama ada3 + H2O → Iman (oh)3
Kami mempunyai tiga elemen: besi (iman), hidrogen dan oksigen. Cadangan pada masa persamaan keseimbangan adalah untuk mula mengira nombor atom unsur yang kurang banyak dalam persamaan; yang biasanya berbeza dengan h dan o. Oleh itu, kita mula -mula mengira atom -atom iman:
Ia dapat melayani anda: metil salisilatIman: 2 - 1
Subskrip 3 dari (oh)3 Jangan melipatgandakan iman di sebelah kiri. Untuk h dan o kita ada:
H: 2 - 3
O: 4 - 3
Semua elemen tidak seimbang.
Berayun
Sebelum keseimbangan h dan o, kita mesti mengimbangi atom -atom iman: elemen paling tidak banyak, kerana tidak ada 3 iman, tidak seperti 5 h dan 7 atau 7 atau 7. Anda perlu menambah iman ke kanan:
Iman: 2 - 2
Apa yang sama dengan meletakkan 2 sebagai pekali stoikiometrik di hadapan iman (OH)3. Persamaan akan kekal:
Iman2Sama ada3 + H2O → 2fe (oh)3
Iman: 2 - 2
H: 2 - 6
O: 4 - 6
Tetapi H dan O atau terus tidak seimbang. H2Atau menyumbang 2 jam dan kami kekurangan 4 jam. Oleh itu, kami akan menambah dua lagi h2Atau bagi kita untuk mempunyai tiga h2Sama ada:
Iman2Sama ada3 + 3h2O → 2fe (oh)3
Dan kita menilai lagi:
Iman: 2 - 2
H: 6 - 6
O: 6 - 6
Perhatikan bagaimana mereka mengimbangi mereka apabila kita pernah mengimbangi H. Persamaan akhirnya seimbang.
Latihan 2
Seimbang atau tidak?
Ch4 + Sama ada2 → Co2 + H2Sama ada
Kami menilai bilangan atom untuk semua elemen sekarang:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Karbon seimbang, tetapi perkara yang sama tidak berlaku dengan hidrogen dan oksigen. Persamaannya tidak seimbang.
Berayun
Oleh kerana C seimbang, kami tidak mahu mengubahsuai pekali stoikiometri CH4 atau co2. Sekurang -kurangnya tidak pada dasarnya.
Kami menumpukan perhatian kami pada H dan O, terutamanya pada H. Kerana? Kerana melihat persamaan itu lebih mudah untuk mengimbangi h sebelum atau. Kita perlu menambah 2 jam ke kanan, meletakkan pekali 2 di hadapan h2Sama ada:
Ch4 + Sama ada2 → Co2 + 2h2Sama ada
C: 1 - 1
H: 4 - 4
O: 2 - 4
C dan H seimbang. Kami ditinggalkan 2 atau kiri. Jika masing -masing atau2 menyumbang 2 atau, kami akan menambah atau2 tambahan supaya mereka berada 4 atau ke kiri. Ini sama dengan meletakkan pekali 2 di hadapan o2:
Boleh melayani anda: Sulfur oksidaCh4 + 22 → Co2 + 2h2Sama ada
C: 1 - 1
H: 4 - 4
O: 4 - 4
Dan persamaan akhirnya seimbang.
Latihan 3
Seimbang atau tidak?
N2 + H2 → NH3
Kami menilai untuk dua elemen kami N dan H:
N: 2 - 1
H: 2 - 3
Persamaan tidak seimbang.
Berayun
Kami mula seimbang n, elemen yang berbeza dari h. Kami tidak mempunyai hak, dan seperti setiap NH3 Menyumbang 1 N, kita mesti menambah NH yang lain3 Mempunyai 2 n:
N2 + H2 → 2nh3
N: 2 - 2
H: 2 - 6
Dan sekarang kita kehilangan kiri. Sekiranya masing -masing h2 Sumbangan 2 jam ke persamaan, maka kita mesti menambah dua lagi sehingga terdapat 6 jam. Ini sama dengan meletakkan pekali stoikiometrik 3 di hadapan h2:
N2 + 3h2 → 2nh3
N: 2 - 2
H: 6 - 6
Dan persamaan kimia akhirnya seimbang.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Kimia Librettexts. (23 November 2020). Cara menulis persamaan kimia seimbang. Pulih dari: chem.Libretxts.org
- Wikipedia. (2020). Persamaan Kimia. Diperoleh dari: dalam.Wikipedia.org
- Prinsip Kimia. (s.F.). Menulis dan mengimbangi persamaan kimia. [Pdf]. Diperolehi dari: web.Ung.Edu
- Phet. (s.F.). Mengimbangi persamaan kimia. Pulih dari: phet.Colorado.Edu
- Armando Marín b. (s.F.). Kimia Umum: Mengimbangi Persamaan. [Pdf]. Pulih dari: DEPA.Fquim.Unam.mx

