Sejarah benzena, struktur, sifat, derivatif, kegunaan

- 4019
- 1255
- Erick Krajcik
Dia benzena Ia adalah sebatian organik yang terdiri daripada salah satu hidrokarbon aromatik yang paling mudah. Formula kimianya adalah c6H6, yang diketahui bahawa hubungan antara karbon dan hidrogen adalah sama dengan 1; iaitu, bagi setiap karbon terdapat hidrogen yang dikaitkan dengan ini.
Walaupun penampilan fizikalnya adalah cecair tanpa warna, ia secara semula jadi dijumpai dalam minyak dan produk yang diperoleh daripadanya. Bau itu sangat ciri, kerana ia menyerupai campuran gam, bitumen dan petrol; Sebaliknya, ia adalah cecair yang tidak menentu dan mudah terbakar.
 Belfing dengan benzena. Sumber: Air1404 [CC oleh 4.0 (https: // creativeCommons.Org/lesen/by/4.0)]
Belfing dengan benzena. Sumber: Air1404 [CC oleh 4.0 (https: // creativeCommons.Org/lesen/by/4.0)] Di bahagian atas imej bekas atau botol dengan benzena ditunjukkan, mungkin kesucian bukan analitik. Sekiranya wap benzena segera ditemui di seluruh makmal. Atas sebab ini cecair ini, yang biasa digunakan sebagai pelarut mudah, dimanipulasi di dalam loceng pengekstrak gas.
Menjadi formula anda C6H6, Kimia abad kesembilan belas menimbulkan banyak struktur yang mungkin sesuai dengan perkadaran tersebut C/H sama dengan 1. Bukan sahaja ini, tetapi molekul benzena terpaksa mempunyai pautan khas sedemikian rupa sehingga kestabilannya yang luar biasa dapat dijelaskan kepada tindak balas tambahan; tipikal untuk alkena dan dasar.
Ia adalah supaya hubungannya mewakili teka -teki untuk bahan kimia pada masa itu; Sehingga harta itu dipanggil Aromatik. Sebelum dianggap hexacyclotriene (dengan tiga bon c = c), benzena lebih banyak daripada itu, dan ia adalah satu lagi dari banyak contoh sinergi dalam kimia.
Dalam kimia organik, benzena adalah simbol klasik, asas struktur untuk sebatian polylaromatic berganda. Dari segi enam, simfin derivatif diperoleh melalui penggantian elektrofilik aromatik; Cincin yang pinggirnya bersempadan dengan struktur yang mentakrifkan sebatian baru.
Malah, derivatifnya berhutang penggunaan perindustrian yang luas bagi mereka yang memerlukan benzena di antara bahan mentah mereka. Dari penyediaan gam tekstil dan serat, ke plastik, karet, pigmen, ubat dan bahan letupan. Sebaliknya, benzena secara semulajadi ditemui di gunung berapi, kebakaran hutan, petrol dan asap rokok.
[TOC]
Sejarah
Penemuan dan nama
Penemuannya bermula pada tahun 1825, biasanya dianugerahkan kepada Michael Faraday, ketika dia mengumpul dan melakukan eksperimen dengan produk minyak yang tinggal dari gas yang digunakan untuk pencahayaan. Cecair ini mengandungi proporsi c/h hampir 1, itulah sebabnya ia menyebutnya 'hidrogen karburet'.
Ahli kimia Auguste Laurent melantik 'pheno' hidrokarbon aneh, yang berasal dari perkataan Yunani 'Phaínein'Apa maksudnya cemerlang (kerana ia diperolehi setelah gas dibakar). Walau bagaimanapun, nama ini tidak diterima oleh komuniti saintifik dan hanya diguna pakai sebagai 'fenil', untuk merujuk kepada radikal yang diperoleh dari benzena.
Dari getah benzoin, ahli kimia Eilhard Mitscherlich, sembilan tahun kemudian, berjaya menghasilkan sebatian yang sama; Oleh itu, ada sumber lain untuk hidrokarbon yang sama, yang dibaptiskan sebagai 'benzina'. Walau bagaimanapun, mereka juga tidak menganggap nama yang sesuai untuk mengandaikan bahawa ia adalah alkaloid, seperti quinine.
Oleh itu, mereka menggantikan nama 'Bencina' oleh 'Benzol'. Walau bagaimanapun, terdapat percanggahan dan percanggahan lagi kerana istilah 'benzol' yang keliru hidrokarbon untuk alkohol. Pada masa itu nama 'Benzene' dilahirkan, digunakan dahulu di Perancis dan England.
Ia boleh melayani anda: Lithium Carbonate (LI2CO3): Struktur, Hartanah, KegunaanPengeluaran industri
Gas pencahayaan mahupun gusi benzoin adalah sumber yang sesuai untuk menjana benzena ke skala besar. Charles Mansfield, bekerja dengan August Wilhelm von Hofmann, yang dicapai pada tahun 1845 mengasingkan benzena (dua puluh tahun selepas penemuannya) dari Hulla Tar, produk lateral pengeluaran kokas.
Oleh itu, pengeluaran industri benzena bermula dari hulla tar. Ketersediaan benzena dalam jumlah besar, memudahkan kajian sifat kimianya dan membenarkannya mengaitkannya dengan sebatian lain dari reaktiviti yang serupa. August Wilhelm von Hofmann mencipta perkataan 'aromatik' untuk benzena dan sebatian yang berkaitan.
Struktur sejarah
Impian Kekulé Ogos
Friedrich August Kekulé dianugerahkan struktur heksagon dan kitaran benzena sekitar tahun 1865, yang timbul dari mimpi aneh dengan Uroboros, ular yang menggigit ekornya sendiri dengan melukis bulatan. Oleh itu, beliau percaya bahawa benzena boleh dianggap sebagai cincin heksagon, dan bahan kimia lain menimbulkan struktur yang mungkin, yang ditunjukkan di bawah:
 Struktur cincin benzena yang dicadangkan sepanjang sejarah. Sumber: Jü [Domain Awam]
Struktur cincin benzena yang dicadangkan sepanjang sejarah. Sumber: Jü [Domain Awam] Beberapa struktur atas dapat membenarkan kestabilan benzena.
Buku, cincin dan prisma
Perhatikan bahawa struktur ketiga bukanlah cincin tetapi prisma segitiga, yang dicadangkan oleh Albert Ladenburg pada tahun 1869; Di sebelah kirinya, sebuah buku terbuka yang dicadangkan oleh Sir James Dewar pada tahun 1867; Dan di sebelah kanannya, satu dengan semua hidrogen yang diarahkan ke pusat cincin, yang dicadangkan oleh Henry Edward Armstrong pada tahun 1887.
Struktur pertama, yang dicadangkan oleh Adolf Karl Ludwig Claus pada tahun 1867, juga agak pelik, kerana pautan C-C diseberang. Dan yang terakhir adalah cincin "Serpentine" Kekulé, bermimpi pada tahun 1865.
Apa itu "pemenang"? Struktur Kelima (dari kiri ke kanan), yang dicadangkan pada tahun 1899 oleh Johannes Thiele.
Dalam hal ini, hibrid resonans dianggap buat pertama kalinya, yang menggabungkan dua struktur Kekulé (menjadikan cincin pertama di sebelah kanan untuk memerhatikannya) dan menjelaskan secara luar biasa penempatan semula elektron dan, dengan itu, sehingga kestabilan yang tidak biasa Benzena.
Struktur benzena
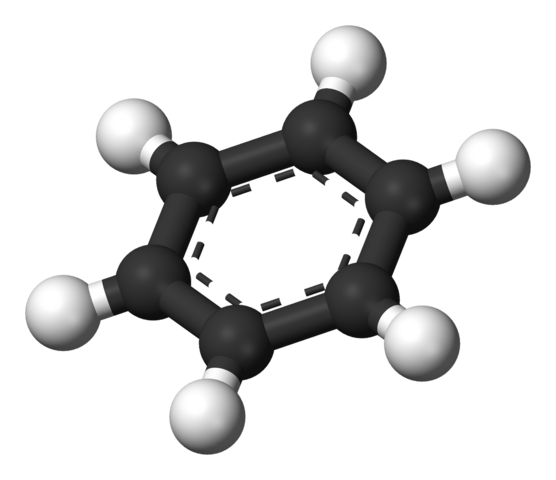 Cincin aromatik benzena. Sumber: Benjah-bmm27 [domain awam]
Cincin aromatik benzena. Sumber: Benjah-bmm27 [domain awam] Struktur yang dicadangkan oleh Thiele ditunjukkan oleh model sfera dan bar.
Molekul benzena rata, dengan atom hidrogen yang menunjuk dari sisi cincin. Semua atom karbon mempunyai hibridisasi SP2, Dengan orbital p Tersedia untuk menubuhkan sistem aromatik di mana enam elektron berpindah.
Ini Carbonos sp2 Mereka lebih banyak elektronegatif daripada hidrogen, dan oleh itu, yang pertama mengeluarkan ketumpatan elektronik ke yang terakhir (cSP2δ--Hδ+). Oleh itu, pusat cincin mempunyai kepekatan elektron yang lebih besar daripada sisinya.
Lebih tepat lagi, sistem aromatik boleh diwakili sebagai awan atau pad elektronik yang diluaskan oleh kedua -dua belah cincin heksagon; dan di tengah, di tepi atau tepi, kekurangan elektronik yang dibentuk oleh hidrogen dengan beban separa positif.
Terima kasih kepada pengedaran caj elektrik ini, molekul benzena dapat berinteraksi antara satu sama lain melalui pasukan dipole-dipolo; Atom hδ+ Mereka merasakan tarikan ke pusat aromatik cincin jiran (di bawah ini akan diwakili).
Begitu juga, pusat aromatik dapat disusun di atas satu sama lain untuk memihak kepada induksi dipole segera.
Boleh melayani anda: alotropiResonans
 Struktur dan hibrid resonans benzena. Sumber: Edgar181 dari Wikipedia.
Struktur dan hibrid resonans benzena. Sumber: Edgar181 dari Wikipedia. Kedua -dua struktur Kekulé ditunjukkan di bahagian atas imej, dan di bawahnya, hibrid resonans. Oleh kerana kedua -dua struktur itu berlaku lagi dan lagi pada masa yang sama, hibrid diwakili dengan bulatan yang ditarik di tengah (serupa dengan "donat heksagon").
Lingkaran hibrid adalah penting kerana ia menunjukkan sifat aromatik benzena (dan banyak sebatian lain). Di samping itu, beliau menegaskan bahawa pautan itu tidak selagi C-C, atau seketika c = c; Tetapi panjangnya antara kedua -dua hujungnya. Oleh itu, benzena tidak dianggap sebagai polyhene.
Di atas telah ditunjukkan dengan pengukuran panjang pautan C-C (139 petang) benzena, yang sedikit lebih panjang daripada bon C-H (109 PM).
Kristal
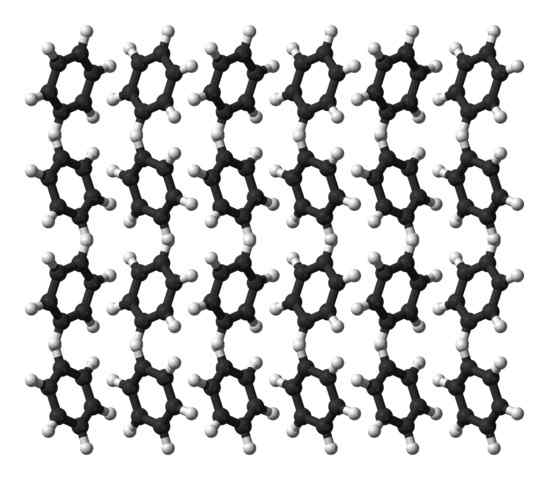 Struktur kristal ortorrombik benzena. Sumber: Ben Mills [Domain Awam]
Struktur kristal ortorrombik benzena. Sumber: Ben Mills [Domain Awam] Benzene adalah cecair pada suhu bilik. Kekuatan intermolecularnya, walaupun mempunyai masa yang jelas, ia dapat mengekalkan molekulnya bersama -sama dalam cecair yang mendidih pada 80ºC. Apabila suhu turun di bawah 5ºC, benzena mula membeku: dan oleh itu kristal yang sepadan mereka diperolehi.
Cincin benzena dapat mengadopsi corak struktur yang ditakrifkan dalam pepejal mereka. Dipoles mereka menjadikan mereka "condong" ke kiri atau kanan, membentuk pangkat yang mampu menghasilkan semula oleh sel ortorrombik orthorm. Oleh itu, kristal benzena adalah ortorrombik.
Perhatikan dalam imej yang unggul bahawa apabila cincin cenderung untuk memihak kepada interaksi antara hδ+ dan pusat aromatik, yang disebutkan dalam sub -bahagian sebelumnya.
Sifat
Jisim molekul
78,114 g/mol.
Penampilan fizikal
Cecair tanpa warna dengan bau yang serupa dengan petrol.
Takat didih
80ºC.
Takat lebur
5.5ºC.
titik pencucuhan
-11ºC (cawan tertutup).
Suhu sendiri
497.78ºC.
Ketumpatan
0.8765 g/ml pada 20ºC.
Kelarutan
Liter air mendidih hampir tidak dapat membubarkan 3.94 g benzena. Watak apolarnya menjadikannya hampir tidak dapat dilepaskan dengan air. Walau bagaimanapun, ia boleh didapati dengan pelarut lain, seperti etanol, ether, aseton, minyak, kloroform, karbon tetraklorida, dll.
Ketumpatan wap
2.8 dalam hubungan udara (iaitu, hampir tiga kali lebih banyak).
Tekanan wap
94.8 mm Hg pada 25ºC.
Haba pembakaran
-3267.6 kJ/mol (untuk benzena cecair).
Haba pengewapan
33.83 kJ/mol.
Ketegangan permukaan
28.22 mn/m A 25ºC.
Indeks refraktif
1,5011 hingga 20ºC.
Derivatif

Hidrogen benzena boleh diganti oleh kumpulan atau atom lain. Mungkin ada satu atau lebih penggantian, meningkatkan tahap penggantian sehingga enam hidrogen asal ada.
Contohnya, Benceno sebagai PH-H, di mana H adalah salah satu daripada enam hidrogennya. Mengingat bahawa pusat cincin mempunyai ketumpatan elektronik yang lebih besar, menarik elektrofil, yang menyerang cincin untuk menggantikan H dalam tindak balas yang disebut penggantian elektrofilik aromatik (SEAR).
Jika h ini digantikan oleh OH, ph-oh, phenol akan ada; menggantikan cho3, Ph-ch3, Toluena; Sekiranya NH2, Ph-nh2, aniline; Atau jika itu cho2Ch3, Ph-ch2Ch3, Ethylbenzene.
Derivatif boleh menjadi sama atau lebih toksik daripada benzena, atau sebaliknya, menjadi begitu rumit sehingga mereka menjadi kesan farmakologi yang diingini.
Boleh melayani anda: kalsium karbida (CAC2): struktur, sifat, mendapatkan, menggunakanAplikasi
Ia adalah pelarut yang baik untuk pelbagai sebatian, hadir misalnya dalam lukisan, varnis, pelekat dan salutan.
Ia juga boleh membubarkan minyak, lemak atau lilin, jadi ia telah digunakan sebagai pelarut pengekstrak intipati. Harta ini digunakan oleh Ludwig Roselius pada tahun 1903 untuk decaffein kopi, operasi yang sudah digunakan kerana ketoksikan benzena. Begitu juga, ia digunakan pada masa lalu untuk merendahkan logam.
Dalam salah satu kegunaan klasiknya, ia tidak bertindak sebagai pelarut tetapi sebagai bahan tambahan: meningkatkan oktana petrol, menggantikan plumbum untuk tujuan ini.
Derivatif benzena boleh mempunyai kegunaan yang berbeza; Ada yang berfungsi sebagai racun perosak, pelincir, detergen, plastik, bahan peledak, minyak wangi, pewarna, gam, dadah, dll. Sekiranya dalam strukturnya terdapat cincin benzenik, kemungkinan besar sintesisnya telah meninggalkan benzena.
Antara derivatif yang paling penting ialah: cumeno, xylene, aniline, fenol (untuk sintesis resin fenolik), asid benzoik (pengawet), siklohexan (untuk sintesis nilon), nitrobenzene, resorcinol dan etilbenzena.
Nomenclature
Nomenklatur derivatif benzena berbeza -beza bergantung kepada tahap penggantian, apakah kumpulan substituen, dan kedudukan relatif mereka. Oleh itu, benzena boleh mengalami monyet, di, tri, tetra, dll., Penggantian
Apabila kedua -dua kumpulan dikaitkan dengan karbon bersebelahan, denominasi 'ortho' digunakan; Sekiranya terdapat karbon di antara memisahkannya, 'matlamat'; Dan jika karbon berada dalam kedudukan yang bertentangan, 'untuk'.
Dalam imej yang lebih rendah, contoh derivatif benzena dengan nama masing -masing yang ditadbir oleh IUPAC ditunjukkan. Mereka juga disertai dengan nama biasa atau tradisional.
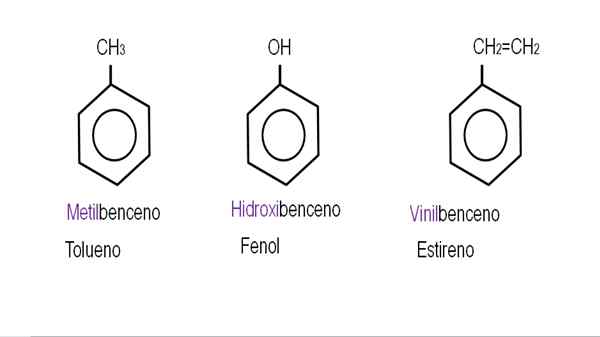 Benzena monoderivasi. Sumber: Gabriel Bolívar.
Benzena monoderivasi. Sumber: Gabriel Bolívar. 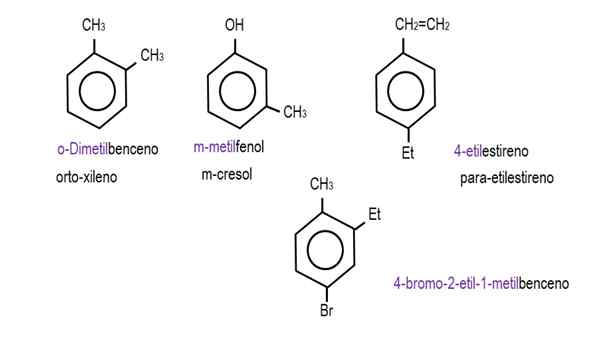 Derivatif benzena lain. Sumber: Gabriel Bolívar.
Derivatif benzena lain. Sumber: Gabriel Bolívar. Perhatikan bahawa dalam Benzene Trisustuated petunjuk ortho, untuk dan matlamat mereka berhenti menjadi berguna.
Ketoksikan
Benzena adalah sebatian yang mesti dimanipulasi dengan teliti. Memandangkan bau tertentu, kesan negatif segera boleh menjadi lemas, pening, sakit kepala, gegaran, mengantuk, loya, dan juga kematian (sebelum pendedahan yang tinggi). Sekiranya, sebagai tambahan kepada apa yang telah disebutkan, sakit perut dan sawan boleh menyebabkan akut.
Di samping itu, kesan panjang di bawah pendedahan berterusan kepada cecair ini adalah karsinogenik; Meningkatkan kemungkinan individu mengalami beberapa jenis kanser, terutama darah: leukemia.
Dalam darah ia dapat mengurangkan kepekatan sel darah merah, menyebabkan anemia, dan juga mempengaruhi sumsum tulang dan hati, di mana ia diasimilasikan oleh badan untuk menghasilkan lebih banyak derivatif benzena toksik; Contohnya, hydroxiquinone. Ia juga berkumpul di buah pinggang, jantung, paru -paru dan otak.
Rujukan
- Morrison, r.T. Dan Boyd, r. N. (1987). Kimia organik. (Edisi ke -5). Addison-Wesley Iberoamericana.
- Carey, f. Ke. (2008). Kimia organik. (Edisi ke -6). McGraw-Hill, Intermerica, Editores s.Ke.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Benzena. Pangkalan data PUBCHEM. CID = 241, pulih dari: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Benzena. Diperoleh dari: dalam.Wikipedia.org
- Garcia Nissa. (2019). Apa itu benzena? - Gunakan, Struktur & Formula. Kajian. Pulih dari: belajar.com
- Pusat Kawalan dan Pencegahan Penyakit. (4 April 2018). Fakta mengenai benzena. Pulih dari: kecemasan.CDC.Gov
- Pertubuhan Kesihatan Dunia. (2010). Pendedahan kepada Benzena: Kebimbangan kesihatan awam utama. [Pdf]. Pulih dari: siapa.int
- Fernández Germán. (s.F.). Masalah tatanama benzena. Kimia organik. Pulih dari: Chemicicaorganica.org
- « Konsep Kosmopolitisme, Asal, Visi Kant, Masyarakat
- Geografi Pelancongan Objek Pengajian, Asal, Sains Bantuan »

