Sejarah Beryllium, Struktur, Hartanah, Kegunaan

- 3539
- 370
- Anthony Breitenberg
Dia Beryllium Ia adalah elemen logam yang dimiliki oleh kumpulan 2 atau IIA jadual berkala. Ia adalah logam alkali paling ringan dalam kumpulan, dan diwakili oleh simbol BE. Atom dan kationnya juga lebih kecil daripada rakan sebaya mereka (MG, CA, MR ...).
Oleh kerana ketumpatan beban yang tidak biasa, logam ini biasanya tidak berlaku secara berasingan. Mereka tahu kira -kira 30 mineral yang mengandunginya, antaranya: beryl (3beo · al2Sama ada3· 62· 2h2O), Bertrandita (4beo.2se2.2h2O), El Chrisoberilo (Beal2Sama ada4), dan fenaquita (menjadi2Yeah4).
 Pipitas Beryll Metallic. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Pipitas Beryll Metallic. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] La Esmeralda, batu berharga, adalah varian beryl. Walau bagaimanapun, berilium tulen tidak begitu menarik; Ia kelihatan kecerahan kelabu pucat (imej unggul), dan telah dicapai dalam bentuk pepitas atau derak.
Beryllium mempunyai satu set sifat fizikal ciri. Ia mempunyai ketumpatan yang rendah; Tingkah laku terma dan elektrik yang tinggi, serta kapasiti haba dan pelesapan haba; Ia bukan logam magnet; dan juga mempunyai kombinasi ketegaran dan keanjalan yang sesuai.
Semua sifat ini telah menyebabkan berilium menjadi logam dengan banyak aplikasi, mulai dari penggunaannya dalam aloi tembaga untuk menghuraikan alat, untuk kegunaannya dalam roket, kapal terbang, kereta, reaktor nuklear, peralatan x -ray, magnetik nuklear resonans, dll dan lain -lain .
Beryllium mempunyai 10 isotop yang diketahui, mulai dari 5Menjadi 14Menjadi, menjadi 9Menjadi satu -satunya stabil. Ia juga merupakan logam yang sangat toksik, yang terutama mempengaruhi sistem pernafasan, jadi ada batasan penggunaannya.
[TOC]
Sejarah Penemuan Anda
Beryllium ditemui oleh Louis-Nicolas Vauguelin pada tahun 1798 sebagai elemen komposisi mineral Berilo, dan aluminium dan berilium silikat.
Selepas itu, ahli kimia Jerman Frederic Wöhler, pada tahun 1828, berjaya mengasingkan berilium dengan bertindak balas kalium dengan berilium klorida dalam periuk platinum.
Pada masa yang sama, dan secara bebas, ahli kimia Perancis Antoine Bussy juga mencapai pengasingan berilium. Wöhler adalah yang pertama mencadangkan nama berilium untuk logam.
Dia menerima nama semasanya pada tahun 1957, kerana dia sebelum ini dikenali sebagai Glucinium, kerana rasa manis beberapa garam. Tetapi, untuk mengelakkan kekeliruan dengan sebatian rasa manis yang lain, dan dengan tumbuhan yang dipanggil glucina, ia diputuskan untuk menukar nama untuk berilium.
Struktur Berily
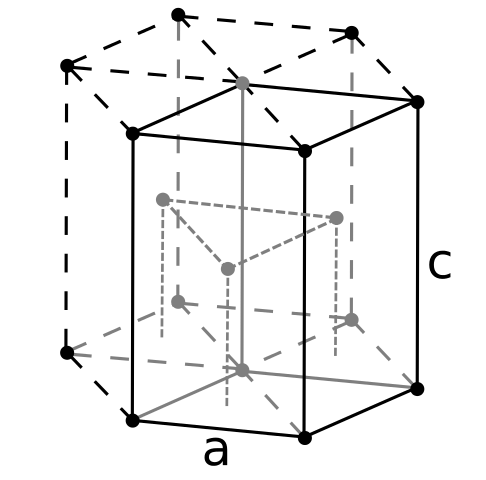 Struktur Berily Crign. Sumber: Pengguna: Dornelf [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Struktur Berily Crign. Sumber: Pengguna: Dornelf [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Menjadi Beryl yang paling ringan dari logam alkalinoterik, harus diharapkan jumlah atomnya akan menjadi yang terkecil dari semua. Atom berilil berinteraksi antara satu sama lain melalui ikatan logam, sehingga "laut elektron" mereka dan penolakan antara model nukleus struktur kaca yang dihasilkan.
Ia boleh melayani anda: asid periódic (HIO4): Apakah, struktur, sifat, kegunaanKristal hitam berilium kemudian dibentuk. Kristal ini mempunyai struktur heksagon (imej unggul), di mana masing -masing mempunyai enam jiran sampingan, dan tiga lagi di atas dan bawah pesawat.
Menjadi kristal hitam, ia berguna. Ini adalah salah satu struktur yang paling padat yang boleh diadopsi oleh logam; Dan masuk akal bahawa atom -atom kecil yang "memerah" kedua -duanya untuk mengelakkan sedikit kekosongan atau bilangan lubang di antara mereka.
Konfigurasi Elektronik
1s22s2
Apa yang sama dengan 4 elektron, yang mana 2 dari Valencia. Sekiranya elektron ke orbital 2p dipromosikan, dua orbital SP Hbíbridos akan. Oleh itu, dalam sebatian berilium mungkin terdapat geometri linear, X-BE-X; Contohnya, molekul becl terpencil2, Cl-be-cl.
Sifat
Penerangan fizikal
Warna kelabu pepejal, cerah dan rapuh.
Takat lebur
1287 ºC.
Takat didih
2471 ºC.
Ketumpatan
- 1,848 g/cm3 pada suhu bilik.
- 1.69 g/cm3 ke titik lebur (keadaan cair).
Radio atom
112 petang.
Radio Covalent
90 malam.
Jumlah atom
5 cm3/mol.
Haba tertentu
1,824 j/g · mol pada 20 ºC.
Haba Fusion
12.21 kJ/mol.
Haba penyejatan
309 kJ/mol.
Elektronegativiti
1.57 pada skala Pauling.
Potensi standard
1.70 v.
Kelajuan bunyi
12.890 m/s.
Pengembangan haba
11.3 μm/m · k pada 25 ° C.
Kekonduksian terma
200 w/m · k.
Sifat kimia
Beryllium ditutup dengan lapisan Beryl Oxide (Beeo) yang berfungsi sebagai perlindungan udara pada suhu bilik. Pengoksidaan berilium berlaku pada suhu yang lebih besar daripada 1000 ºC, yang berasal dari produk berilium oksida dan berilium nitrida.
Ia juga tahan terhadap tindakan asid nitrik 15 m. Tetapi, ia larut dalam asid hidroklorik dan alkali, seperti natrium hidroksida.
Aplikasi
Penyediaan alat
Beryllium membentuk aloi dengan tembaga, nikel dan alumino. Khususnya aloi dengan tembaga menghasilkan alat kekerasan dan rintangan yang besar, yang membentuk hanya 2% daripada berat aloi.
Alat ini tidak menghasilkan percikan api ketika memukul besi, yang membolehkan mereka digunakan dalam persekitaran dengan kandungan gas mudah terbakar yang tinggi.
Boleh melayani anda: termal: struktur, ciri, pembentukan, contohOleh kerana ketumpatannya yang rendah ia mempunyai berat ringan, yang, bersama -sama dengan ketegarannya, membolehkan penggunaannya dalam pesawat angkasa, roket, peluru berpandu dan kapal terbang. Aloi dengan Beryllium telah digunakan dalam penjelasan bahagian kereta. Ia juga telah digunakan di penjelasan mata air.
Kerana kekerasan besar yang diberikan oleh berilium ke aloi, ini telah digunakan dalam brek pesawat tentera.
Mencerminkan penjelasan
Beryllium telah digunakan dalam pengeluaran cermin kerana kestabilan dimensi dan keupayaannya untuk mempunyai pulter yang tinggi. Cermin ini digunakan dalam satelit dan sistem kawalan kebakaran. Di samping itu, teleskop ruang digunakan.
Dalam radiasi pengion
Beryllium adalah elemen ketumpatan yang rendah, jadi ia dapat dianggap telus ke x -rays. Ciri ini membolehkan penggunaannya dalam pembinaan tingkap tiub yang menghasilkan x -rays, aplikasi perindustrian dan diagnosis perubatan.
Begitu juga, berilium digunakan dalam tingkap pengesan pelepasan radioaktif.
Dalam pasukan menjana magnet
Antara ciri -ciri berilium, tidak menjadi elemen magnet. Ini membolehkan ia digunakan dalam pembinaan artikel peralatan resonans magnetik, di mana medan magnet intensiti yang besar dihasilkan, meminimumkan sebarang gangguan.
Reaktor nuklear
Oleh kerana titik gabungan yang tinggi, ia telah menemui aplikasi dalam reaktor nuklear dan seramik. Beryllium digunakan sebagai moderator reaksi nuklear dan sebagai pengeluar neutron:
9Menjadi + 4Dia (α) => 12C +n (neutron)
Dianggarkan bahawa untuk satu juta atom beryl yang dibom dengan zarah α, sehingga 30 juta neutron berlaku. Tepatnya tindak balas nuklear ini membolehkan penemuan neutron.
James Chadwick membombardir atom berilium dengan zarah α (dia). Penyelidik memerhatikan pembebasan zarah subátomik, tanpa caj elektrik, yang membawa kepada penemuan neutron.
Pelindung logam
Tambahkan jumlah berilium di permukaan logam yang boleh dioksidakan, memberikan perlindungan tertentu. Contohnya, kebolehupayaan magnesium dikurangkan dan kecerahan aloi perak berpanjangan.
Di mana ia berada?
Beryl ditemui di pegmatit, dikaitkan dengan mika, feldspar dan kuarza. Melalui penggunaan teknik pengapungan, ada kemungkinan untuk memisahkan campuran beryl dan feldspar. Selanjutnya, feldspar dan beryl tertumpu dan tertakluk kepada rawatan dengan hipoklorit kalsium.
Ia boleh melayani anda: perbezaan antara sebatian organik dan bukan organikDiikuti dengan rawatan dengan asid sulfurik dan kalium sulfonat, melalui pencairan, pengapungan beryl dicapai, memisahkannya dari feldspar.
Beryl dirawat dengan natrium fluorosylicate dan soda pada 770 ºC untuk membentuk natrium fluoroberile, aluminium oksida dan silikon dioksida. Kemudian berilium hidroksida natrium hidroksida hidroksida penyelesaian fluorroberile.
Beryllium fluoride dibentuk dengan bertindak balas berilik hidroksida dengan fluorida hidrogen ammoniacal, menghasilkan ammonium ammonium. Ini dipanaskan untuk membentuk berilium fluorida, yang dirawat dengan magnesium panas untuk mengasingkan berilium.
Risiko
Beryllium sebagai logam yang dibahagikan halus, dalam bentuk penyelesaian, debu kering atau asap, sangat toksik dan boleh menghasilkan dermatitis. Walau bagaimanapun, ketoksikan terbesar dihasilkan oleh penyedutan.
Pada mulanya, berilium boleh menyebabkan hipersensitiviti atau alahan, yang boleh menjadi beliosis atau penyakit kronik berilium (CBD). Ini adalah penyakit yang serius, dicirikan oleh penurunan kapasiti paru -paru.
Penyakit akut jarang berlaku. Dalam penyakit kronik terdapat pembentukan firuloma di seluruh badan, terutama di paru -paru. Beliosis kronik menyebabkan dyspnea progresif, batuk dan kelemahan umum (asthenia).
Beliosis akut boleh mematikan. Dalam Belliosis kehilangan fungsi pernafasan yang progresif berlaku, kerana terdapat halangan dalam aliran saluran udara di saluran pernafasan dan pengoksigenan penurunan tekanan darah darah.
Rujukan
- Persatuan Kimia Diraja. (2019). Beryllium. Pulih dari: RSC.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Beryllium. Pangkalan data PUBCHEM. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Helmestine, Anne Marie, Ph.D. (15 Mac, 2019). Fakta Beryllium. Pulih dari: Thoughtco.com
- Wikipedia. (2019). Beryllium. Diperoleh dari: dalam.Wikipedia.org
- Lentech b. V. (2019). Beryllium-be. Pulih dari: lentech.com
- Bahan Perbadanan. (2019). Ketahui mengenai berilium elemen yang pulih dari: Beryllium.com
- D. Michaud. (12 April 2016). Masalah pemprosesan & pengekstrakan berilium. 911 metallurgist. Pulih dari: 911metallurgist.com
- Timothy p. Hanusa. (5 Januari 2016). Beryllium. Encyclopædia Britannica. Pulih dari: Britannica.com
- Baca s. Lelaki Baru. (2014). Penyakit Beryllium. Manual MSD. Pulih dari: msdmanual.com
- « Sejarah Psikologi Sukan, Objektif dan Profil
- Globalisasi Sosial Dimensi, Kelebihan dan Contoh Sosial »

