Komponen Rantaian Penghantar Elektron, Urutan, Inhibitor
- 1309
- 205
- Horace Gulgowski
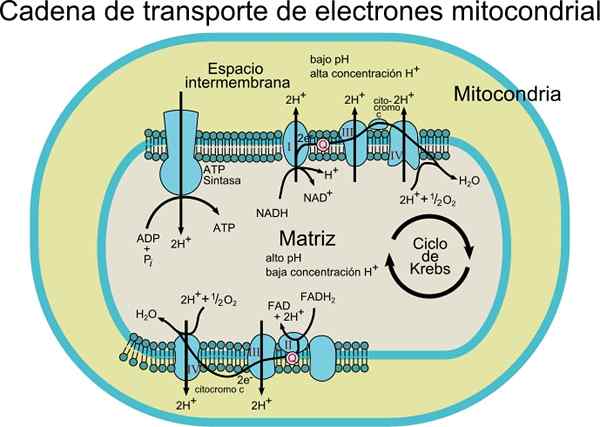
The Rantai penghantar elektron Ia terdiri daripada satu set molekul protein dan koenzim di dalam membran. Seperti namanya, ia bertanggungjawab untuk pengangkutan elektron dari koenzim NADH atau FADH2 kepada penerima akhir iaitu O2 (oksigen molekul).
Dalam proses pengangkutan ini, tenaga yang dikeluarkan dengan memindahkan elektron dari koenzim ke oksigen molekul oleh pusat redoks yang bersatu dengan protein, dikaitkan dengan pengeluaran tenaga (ATP). Tenaga ini diperoleh terima kasih kepada kecerunan proton yang dihasilkan dalam membran dalaman mitokondria.
 Sumber: Pengguna: Rozzychan [CC BY-SA 2.5 (https: // creativeCommons.Org/lesen/by-sa/2.5)]
Sumber: Pengguna: Rozzychan [CC BY-SA 2.5 (https: // creativeCommons.Org/lesen/by-sa/2.5)] Sistem pengangkutan ini terdiri daripada pelbagai komponen yang boleh didapati di sekurang -kurangnya dua keadaan pengoksidaan. Setiap daripada mereka dikurangkan dengan berkesan dan reoxyd semasa pergerakan elektron dari NADH atau FADH2 hingga O2.
Coenzim NAD+ dan FAD dikurangkan dalam laluan pengoksidaan asid lemak dan kitaran asid sitrik akibat pengoksidaan pelbagai substrat. Selanjutnya koenzim ini dioksidakan dalam rantai pengangkutan elektronik.
Supaya sistem pengangkutan elektronik terdiri daripada urutan tindak balas pengurangan oksida yang disambungkan antara satu sama lain.
[TOC]
Komponen rantai
Bergantung pada jenis organisma, 3 hingga 6 komponen dapat diperhatikan yang membentuk rantai penghantar elektron. Proses pengangkutan elektron dan sintesis ATP oleh fosforilasi oksidatif adalah proses yang berlaku dalam membran.
Dalam kes sel prokariotik (bakteria aerobik), proses ini berlaku berkaitan dengan membran plasma. Dalam sel eukariot ia berlaku dalam membran mitokondria, jadi komponen pengangkutan elektron terdapat di bahagian dalaman membran.
https: // giphy.com/gifs/htksbbedquK9z7co5e
Elektron secara beransur -ansur dipindahkan melalui empat kompleks yang membentuk rantai pengangkutan elektronik.
Setiap kompleks mempunyai beberapa komponen protein yang dikaitkan dengan kumpulan prostetik (komponen asid bukan amino protein konjugasi) redoks, yang membolehkan potensi pengurangan mereka meningkat.
Di samping itu, sistem pengangkutan ini terdiri daripada pelbagai spesies molekul seperti flavoprotein; Coenzyme yang juga dikenali sebagai Ubiquinona (Coq atau UQ); Pelbagai cytochromes seperti cytochrome b, c, c1, a dan a3; Protein dengan kumpulan Fe-S dan protein yang dikaitkan dengan CU. Molekul ini dikaitkan dengan membran, kecuali cytochrome c.
Kompleks i
https: // giphy.com/gifs/rlf1rl9gdc6356sj6w
Kompleks I yang dipanggil NADH Coenzyme quinona oxidortaduase, atau NADH dehydrogenase, terdiri daripada sekitar 45 rantai polipeptid. Seperti namanya, kompleks ini memindahkan sepasang elektron dari Coenzyme NADH ke Coq.
Fungsi kompleks dehidrogenase NADH bermula dengan kesatuan NADH untuk mengatakan kompleks di sisi matriks membran mitokondria dalaman. Elektron kemudian diangkut dari NADH ke FMN. Selepas itu, elektron lulus dari flavin yang dikurangkan (FMNH2) ke protein Fe-S.
FMNH2 berfungsi sebagai sejenis jambatan antara NADH dan protein Fe-S, kerana yang terakhir hanya dapat memindahkan elektron tunggal, sementara Coenzyme NADH memindahkan dua, sehingga Flavinas membuat pemindahan elektron tunggal ini kepada redoksnya dari separa -cynone.
Boleh melayani anda: monocytopoiesis: peringkat, ciri, peraturanAkhirnya, elektron dipindahkan dari kumpulan Fe-S ke Coenzyme Q, yang merupakan penghantar elektron mudah alih dengan ekor isopreneid yang menjadikannya hidrofobik membolehkan menyeberangi pusat membran mitokondria.
Kompleks II

Kompleks II, lebih dikenali sebagai dehidrogenase succinate, adalah protein integral membran dalaman mitokondria, dan merupakan enzim yang campur tangan dalam kitaran asid sitrik.
Kompleks ini terdiri daripada dua subunit hidrofilik dan dua hidrofobik dengan kumpulan hemo B yang menyediakan tapak mengikat COQ, sebagai tambahan kepada flavoprotein dan protein dengan Fe-S.
Dalam kitaran asid sitrik (Krebs atau kitaran asid tricarboxylic), succinate ditukar kepada fumarate oleh succinate dehydrogenase, mengurangkan fad coenzyme ke FADH2. Dari coenzyme terakhir ini, elektron dipindahkan ke pusat Fe-S yang seterusnya memindahkan mereka ke Coq.
Semasa reaksi pemindahan elektron ini, potensi redoks standard sangat rendah, yang menghalang tenaga bebas yang diperlukan daripada dibebaskan untuk mensintesis ATP.
Ini bermakna bahawa kompleks II adalah satu -satunya kompleks dalam rantaian pengangkutan elektron yang tidak dapat memberikan tenaga untuk sintesis ATP. Walau bagaimanapun, kompleks ini adalah kunci dalam proses, kerana ia memindahkan elektron dari FADH2 ke seluruh rantai.
Kompleks III
https: // giphy.com/gifs/cjg0raiuizjds2hkyu
Kompleks III, kompleks cytochrome kompleks BC1 atau Coq cytochrome c reductase, memindahkan elektron dari coenzyme yang dikurangkan ke cytochrome c. Pemindahan ini berlaku melalui satu jalan redoks tunggal, yang dikenali sebagai kitaran Q.
Kompleks ini terdiri daripada protein dengan Fe-S dan tiga cytochromes yang berbeza, di mana atom besi yang terletak di dalam kumpulan hemo berbeza-beza di antara keadaan yang dikurangkan (Fe2+) dan teroksida (Fe3+).
Cytochromes adalah hemoprotein pengangkutan elektronik, yang mempunyai aktiviti redoks. Mereka hadir dalam semua organisma, kecuali beberapa anaerob wajib.
Protein ini mempunyai kumpulan hemo yang bergantian antara dua keadaan pengoksidaan (Fe2+ dan Fe3+). Cytochrome C adalah pengangkut elektron mudah alih yang lemah dikaitkan dengan membran dalaman mitokondria.
Cytochromes yang terdapat di kompleks ini adalah cytochromes b, c dan a, 3 adalah protein redoks aktif dengan kumpulan kita mempunyai ciri -ciri yang berbeza, yang menggantikan keadaan pengoksidaan mereka antara Fe2+ dan Fe3+.
Cytochrome C adalah protein membran periferal yang berfungsi sebagai "pesawat ulang -alik" elektron dengan cytochrome C1 dan dengan kompleks IV.
Kompleks IV
Cytochrome C dan O2 adalah reseptor akhir elektron yang diperolehi daripada pengoksidaan bahan organik, jadi kompleks IV atau cytochrome c oksidase adalah enzim terminal dalam proses pengangkutan elektronik. Ini menerima elektron dari cytochrome c dan memindahkan mereka ke pengurangan O2.
Fungsi kompleks adalah untuk memangkinkan pengoksidaan elektron dari empat molekul berturut -turut cytochrome c yang dikurangkan, iaitu, secara serentak mengurangkan empat elektron molekul O2, akhirnya menghasilkan dua molekul H2O.
Boleh melayani anda: Tisu salutan epiteliumUrutan pengangkutan elektron
Elektron dipindahkan dari kompleks I dan II ke kompleks III terima kasih kepada Coenzyme Q, dan dari sana mereka lulus ke kompleks IV melalui sitokrom c. Apabila elektron melewati empat kompleks ini, potensi pengurangan meningkat, melepaskan tenaga, yang kemudiannya digunakan untuk sintesis ATP.
Secara keseluruhan, pemindahan beberapa elektron menyebabkan translocation 10 proton melalui membran; Empat di kompleks I dan IV dan dua kompleks III.
Nadh descidrogenasa
Enzim ini memangkinkan pengoksidaan koenzim NADH oleh koenzim itu. Elektron bergerak dari NADH ke FMN yang dilampirkan pada ekor hidrofilik kompleks i. Pengumpulan Fe-S dipindahkan ke elektron pada satu masa. Kumpulan-kumpulan Fe-S ini berkurangan kepada COQ, yang tertanam dalam membran, ke ubiquinol (dikurangkan Coq).
Semasa pemindahan elektron ke COQ, empat proton pula dipindahkan melalui membran dalaman, ke ruang intermembranal. Mekanisme yang mana proton ini ditranslocated melibatkan protein yang terletak di ekor hidrofobik kompleks i.
Proses pemindahan elektron dalam langkah ini mengeluarkan tenaga bebas, khususnya -16.6 kcal/mol.
Coq-citocromo c reductase dan kitaran Q
Coenzyme yang dioksidakan oleh cytochrome c, dalam reaksi yang dikatalisis oleh koenzim ini. Pengoksidaan ubiquinol (dikurangkan Coq) berlaku di tapak tertentu kompleks (QO atau tapak pengoksidaan) dalam membran mitokondria, memindahkan dua elektron, satu ke protein dengan kumpulan Fe-S dan satu lagi kepada kumpulan hemo.
Dalam kitaran Q, pengoksidaan COQ menghasilkan separuh -quinone, di mana elektron dipindahkan ke kumpulan hemo B1 dan BH. Semasa pemindahan elektron ini berlaku, COQ kedua mengoksidakan di tapak QO, mengulangi kitaran.
Kitaran ini menyebabkan pemindahan dua elektron dan seterusnya translokasi empat proton ke ruang intermembranal, dengan pembebasan -10.64 kcal/mol tenaga bebas.
Citocroma C Oxidase
Enzim (kompleks IV) ini memangkin pengoksidaan cytochrome c (dikurangkan) oleh O2, yang merupakan penerima elektron akhir. Pemindahan ini menghasilkan molekul H2O bagi setiap pasangan elektron yang dipindahkan sebagai tambahan kepada translokasi proton melalui membran.
Elektron bergerak dari satu ke satu, dari cytochrome c yang dikurangkan ke sepasang ion CUA, maka mereka melangkah ke hemo satu kumpulan dan akhirnya sampai ke pusat binuklear kompleks yang mengandungi ion cub dan hemo A3, di mana pemindahan empat elektron berlaku kepada oksigen.
Dalam kompleks IV, unsur -unsur memindahkan elektron satu demi satu, supaya O2 dikurangkan secara beransur -ansur, sehingga pembebasan beberapa sebatian toksik seperti superoxide, hidrogen peroksida atau radikal hidroksil tidak berlaku.
Tenaga yang dikeluarkan pada tahap ini sepadan dengan -32 kcal/mol. Kecerunan elektrokimia yang dihasilkan semasa proses pemindahan dan perubahan tenaga (ΔE) yang disebabkan oleh beberapa elektron ketika melewati empat kompleks, sepadan, pada setiap peringkat, kepada tenaga bebas yang diperlukan untuk pengeluaran molekul ATP.
Boleh melayani anda: teori lipat membranDehydrogenase yang hebat
Seperti yang disebutkan, kompleks ini mempunyai satu -satunya fungsi penting untuk memperkenalkan elektron FADH2 dari kitaran asid sitrik ke rantai pengangkutan elektron.
Enzim ini memangkinkan pengoksidaan Coenzyme FADH2 oleh Coenzyme Q (teroksida). Dalam kitaran asid sitrik apabila succinate ke fumarate, dua elektron dan dua proton dipindahkan ke fad. Seterusnya FADH2 memindahkan elektron ini sehingga COQ melalui pusat Fe-S kompleks.
Akhirnya, dari COQ, elektron dipindahkan ke kompleks III, berikutan langkah -langkah yang diterangkan di atas.
Kompleks rantai bebas
Empat kompleks yang membentuk rantaian pengangkutan elektronik adalah bebas, iaitu, mereka secara bebas dan beroperasi dalam membran dalaman mitochcondrial, dan pergerakan masing -masing dalam membran tidak bergantung atau dikaitkan dengan kompleks lain.
Kompleks I dan II bergerak dalam membran dengan memindahkan elektron mereka ke Coq yang juga merebak ke dalam membran dan memindahkannya ke kompleks III, dari mana elektron melewati cytochrome c yang juga mudah alih dalam membran dan mendepositkan elektron di kompleks IV.
Inhibitor rantai pengangkutan elektronik
Mengenai rantaian pengangkutan elektronik beberapa perencat tertentu bertindak dalam proses mereka. Rothenone adalah insektisida yang biasa digunakan yang secara stoikiometri bergabung dengan kompleks I, mengelakkan pengurangan Coq.
Beberapa jenis ubat barbiturates seperti piericidine dan amytal, menghalang kompleks I, mengganggu pemindahan elektron dari kumpulan Fe-S ke COQ.
Dalam kompleks II beberapa sebatian seperti theoiltrifluoroacetone dan malonat bertindak sebagai inhibitor kompetitif dengan succinate, mengelakkan pengoksidaan mereka dan seterusnya pemindahan elektron ke fad.
Beberapa antibiotik seperti myxotiazole dan stigmatellin, mengikat ke tapak Q COQ, menghalang pemindahan elektron dari koenzim Q ke pusat Fe-S protein.
Cyanide, azida (N3-), asid sulfurik, dan karbon monoksida menghalang kompleks IV. Sebatian ini mengikat kumpulan hemo, mengelakkan pemindahan elektron ke pusat binuklear kompleks atau oksigen (O2) (O2).
Apabila rantaian penghantar elektron dihalang, pengeluaran tenaga dihentikan akibat fosforilasi oksidatif, menyebabkan kerosakan yang serius dan juga kematian organisma.
Rujukan
- Alberts, b., Bray, d., Hopkin, k., Johnson, a., Lewis, J., Raff, m., Roberts, k. & Walter, p. (2004). Biologi sel penting. New York: Sains Garland. Edisi ke -2.
- Cooper, g. M., Hausman, r. Dan. & Wright, n. (2010). Sel. (ms. 397-402). Ed. Marbán.
- Devlin, t. M. (1992). Buku Teks Biokimia: Dengan Korelasi Klinikal. John Wiley & Sons, Inc.
- Garrett, r. H., & Grisham, c. M. (2008). Biokimia. Ed. Thomson Brooks/Cole.
- Rawn, j. D. (1989). Biokimia (no. 577.1 mentah). Ed. Inter-American-McGraw-Hill
- Voet, d., & Voet, j. G. (2006). Biokimia. Ed. Pan -American Medical.
- « Ciri -ciri Anguila Elektrik, Habitat, Pembiakan
- Ciri -ciri Biozoos, Morfologi, Pembiakan, Pemakanan »

