Sejarah Kadmium (CD), sifat, struktur, kegunaan

- 3169
- 429
- Anthony Breitenberg
Dia kadmium (CD) adalah logam peralihan atau post -transisional nombor atom 48 dan warna perak. Ia mudah dibentuk dan mulur, dengan titik lebur dan mendidih yang agak rendah. Kadmium adalah elemen yang jarang berlaku dan hampir tidak mempunyai kepekatan 0.2 g / tan kerak bumi.
La Greenockita (CDS) adalah satu -satunya mena penting kadmium yang memberikan warna kuning yang sengit. Kadmium dikaitkan dengan zink dalam sphalerite (ZnS), yang mengandungi antara 0.1 dan 03 % kadmium sebagai kation CD2+.
 Kristal kadmium. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]
Kristal kadmium. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)] Semasa memproses sphannel untuk mendapatkan, penanaman dan penapisan zink, kadmium diperolehi secara menengah, ini menjadi sumber pengeluaran utamanya.
Logam ini ditemui pada tahun 1817, secara bebas oleh Friedrich Stromayer dan Karl Hermann. Stromayer membaptiskan elemen baru dengan nama kadmium, berasal dari perkataan Latin "kadmia", istilah sebagai calamine (zink karbonat) diketahui (zink karbonat).
 Kadmium adalah elemen kimia dengan simbol CD dan nombor atomnya ialah 48. Sumber: Albedo-Ukr CC By-SA 2.5 (http: // creativeCommons.Org/lesen/by-sa/2.5/)
Kadmium adalah elemen kimia dengan simbol CD dan nombor atomnya ialah 48. Sumber: Albedo-Ukr CC By-SA 2.5 (http: // creativeCommons.Org/lesen/by-sa/2.5/) Cadmium adalah elemen utiliti yang hebat dan banyak aplikasi, seperti besi antikorrosif, keluli dan bukan logam; gunakan sebagai pigmen; Penstabilan PVC; elemen dalam aloi yang digunakan dalam kimpalan; Bateri nikel-kadmium boleh dicas semula, dll.
Walau bagaimanapun, ia adalah elemen yang sangat toksik yang menyebabkan kerosakan teruk pada paru -paru, buah pinggang dan tulang, dan juga tindakan karsinogenik telah ditunjukkan, itulah sebabnya penggunaannya telah terhad. Tetapi walaupun begitu, ia terus digunakan dengan teliti dalam beberapa aplikasi.
[TOC]
Sejarah
- Penemuan berganda
Kadmium ditemui oleh Friedrich Stromayer, seorang ahli kimia Jerman, pada tahun 1817 dalam sampel zink karbonat (calamina). Pada tahun yang sama, k. S. L. Hermann dan J. C. H. Roloff membuat penemuan yang sama, secara bebas, dalam eksperimen yang dijalankan dengan zink sulfida.
Telah dinyatakan bahawa Stromayer membuat penemuannya semasa pemenuhan permohonan kerajaan untuk memeriksa farmasi kota Hildesheim, Jerman. Zink oksida, seperti sekarang, digunakan dalam rawatan keadaan kulit tertentu.
Nampaknya farmasi tidak mengeluarkan zink oksida, tetapi sebaliknya dijual zink karbonat: bahan mentah untuk pengeluaran zink oksida. Pengeluar oksida zink berpendapat bahawa zink karbonat dipanaskan "zink oksida" kuning.
Kadmium oksida
Mereka tidak dapat menjual "zink oksida" ini, kerana warna sebatian biasanya putih; Dan sebaliknya, mereka menjual zink karbonat, juga putih. Memandangkan keadaan ini, Stromayer memutuskan untuk mengkaji zink oksida kuning yang dikatakan.
Untuk melakukan ini, dia menghangatkan sampel zink karbonat (calamine) dan terdapat zink oksida kuning, seperti yang dimaklumkan. Setelah menganalisisnya, dia menyimpulkan bahawa warna kuning adalah produk kerana kehadiran oksida logam dari elemen baru.
Setelah mengekstrak oksida logam baru ini, ia menghasilkan pengurangannya, mencapai penebat kadmium. Stromayer menentukan ketumpatannya dan memperoleh nilai 8.75 g/cm3, Dekat dengan nilai yang diketahui sekarang untuk parameter ini (8.65 g/cm3).
Begitu juga, Stromayer menegaskan bahawa elemen baru mempunyai penampilan yang serupa dengan platinum, dan ia juga terdapat dalam banyak sebatian zink, dan termasuk dalam zink yang disucikan.
Stromayer mencadangkan nama "kadmium" dari suara Latin "kadmia", nama yang dipanggil Calamina, Znco3.
Kadmium dalam zink sulfida
Karl Hermann (1817) menemui warna kuning yang tidak dapat diproses ketika dia memproses zink sulfida dan menyangka ia boleh menjadi pencemaran dengan arsenik. Tetapi apabila kemungkinan ini dibuang, Hermann menyedari bahawa dia berada di hadapan elemen baru.
- Aplikasi
1840-1940
Pada tahun 1840 -an penggunaan kadmium mula dieksploitasi sebagai pigmen. Codex farmaseutikal British menunjukkan pada tahun 1907 penggunaan kadmium iodida sebagai ubat untuk merawat "sendi yang diperbesar", kelenjar scrofulous dan sabañones.
Pada tahun 1930 -an dan 1940 -an, pengeluaran kadmium ditakdirkan untuk platinum keluli dan besi untuk melindungi mereka dari kakisan. Pada tahun 1950 -an, sebatian kadmium digunakan, seperti kadmium sulfida dan kadmium selenide sebagai sumber pigmen merah, oren dan kuning.
1970-1990
Pada tahun 1970 -an dan 1980 -an didapati bahawa kadmium kadmium dan sebatian stearate adalah penstabil PVC, yang menghasilkan peningkatan dalam permintaan kadmium. Walau bagaimanapun, peraturan alam sekitar disebabkan oleh ketoksikan kadmium.
Pada tahun 1980-an dan 1990-an, kadmium berhenti menggunakan banyak aplikasinya, tetapi pengeluarannya meningkat dengan penciptaan bateri yang boleh dicas semula kadmium nikel, yang mewakili 80 % penggunaan kadmium di Amerika Syarikat.
Boleh melayani anda: kegunaan dan aplikasi alceansSifat fizikal dan kimia kadmium
Penampilan
Kelabu dan kelabu lembut -putih putih. Ia menjadi rapuh dengan pendedahan kepada 80 ºC, dapat dipotong dengan pisau. Mudah dibentuk dan gulungan dapat dibentuk dengannya.
Berat atom standard
112,414 u
Nombor atom (z)
48
Kategori elemen
Logam post -transisi, secara bergantian dianggap logam peralihan. Takrif IUPAC dari logam peralihan adalah salah satu yang atomnya mempunyai subcap yang tidak lengkap atau yang boleh membawa kepada kation dengan subcap yang tidak lengkap.
Menurut definisi itu, kadmium bukan logam peralihan sejak kation CDnya2+ Ia mempunyai orbital 4D yang penuh dengan elektron (4D10).
Bau
Lavatory
Takat lebur
321.07 ºC
Takat didih
767 ºC
Ketumpatan
Suhu ambien: 8.65 g/cm3
Di titik lebur (cecair): 7,996 g/cm3
Haba Fusion
6.21 kJ/mol
Haba pengewapan
99.87 kJ/mol
Kapasiti kalori molar
26,020 j/(mol · k)
Elektronegativiti
1.6 Pada skala Pauling
Tenaga pengionan
Pertama: 867.8 kJ/mol (CD+ gas)
Kedua: 1631.4 kJ/mol (CD2+ gas)
Ketiga: 3616 kJ/mol (CD3+ gas)
Kekonduksian terma
96.6 w/(m · k)
Resistivity Elektrik
72.7 nΩ · m pada 22 ° C
Kekerasan
2.0 pada skala Mohs. Ia adalah logam, walaupun padat, sangat lembut.
Kestabilan
Ia perlahan -lahan dioksidakan oleh udara basah untuk membentuk kadmium oksida, yang mencemarkan kecerahan logamnya. Ia tidak mudah terbakar, tetapi dalam bentuk habuk ia dapat membakar dan mengalami peninjauan diri.
Arah diri
250 ºC untuk kadmium adalah bentuk habuk.
Indeks refraktif
1.8 hingga 20 ºC
Reaktiviti
Kadmium boleh terbakar di udara untuk membentuk kadmium oksida (CaO), debu amorf coklat, manakala bentuk kristal berwarna merah gelap.
Cadmium bertindak balas dengan cepat dengan asid nitrik yang dicairkan, dan perlahan dengan asid hidroklorik panas. Dia juga dapat bertindak balas dengan asid sulfurik, tetapi tidak bertindak balas dengan alkali. Dalam semua tindak balas ini, garam kadmium anion yang sepadan mereka terbentuk (CL-) atau oxoanion (tidak3- Dan juga42-).
Struktur dan konfigurasi elektronik
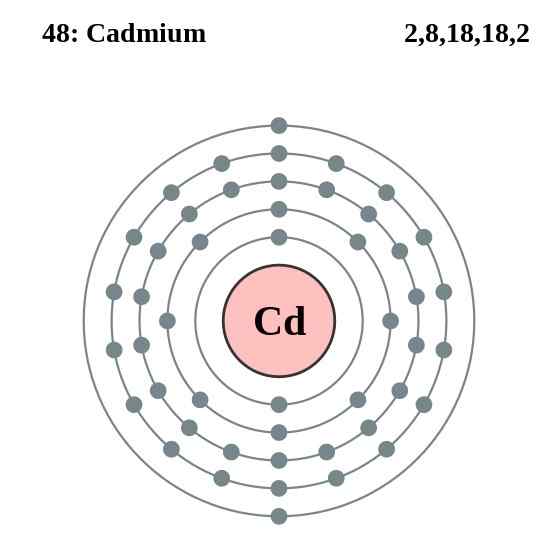 Gambar Rajah Lapisan Elektron Kadmium, Elemen 48 dalam Jadual Berkala. Sumber: Pumbaa (karya asal oleh Greg Robson) CC By-SA 2.0 (http: // creativeCommons.Org/lesen/by-sa/2.0/)
Gambar Rajah Lapisan Elektron Kadmium, Elemen 48 dalam Jadual Berkala. Sumber: Pumbaa (karya asal oleh Greg Robson) CC By-SA 2.0 (http: // creativeCommons.Org/lesen/by-sa/2.0/) Atom kadmium kaca mereka menubuhkan ikatan logam dari elektron valensi mereka, yang terletak di orbital 4D dan 5S mengikut konfigurasi elektronik mereka:
[KR] 4D10 5s2
Walau bagaimanapun, walaupun orbital 4D penuh dengan elektron, dan ia juga boleh dianggap bahawa "laut elektron" berlimpah dengan kuat untuk mengatasi atom CD, pada hakikatnya interaksi lemah. Ini dapat ditunjukkan secara eksperimen dengan titik lebur yang rendah (321 ºC), berbanding dengan logam peralihan lain.
Oleh itu, dan sebab -sebab kimia lain, kadmium kadang -kadang tidak dianggap sebagai logam peralihan. Terdapat begitu banyak elektron (dua belas) yang terlibat dalam ikatan logam mereka, yang mula mengganggu penolakan negatif mereka; yang, bersama-sama dengan perbezaan tenaga antara orbital 4D penuh dan 5s, melemahkan interaksi CD-CD.
Atom CD akhirnya menentukan struktur kristal heksagon padat (HCP), yang tidak mengalami peralihan fasa sebelum titik leburnya. Apabila kristal Cadmium HCP menjalani tekanan bersamaan dengan 10 GPa, strukturnya hanya cacat; Tetapi tanpa melaporkan sebarang perubahan fasa.
Nombor pengoksidaan
Kadmium tidak boleh kehilangan dua belas elektron Valencia; Sebenarnya, anda tidak boleh kehilangan salah satu orbital 4Dnya, lebih stabil dalam tenaga berbanding 5s orbital. Oleh itu anda hanya boleh kehilangan dua elektron orbit 5s2, akibatnya logam divalen; Seperti logam zink, merkuri dan alkali (MR. Scholambara).
Apabila kewujudan kation CD diandaikan dalam sebatiannya2+, Kemudian dikatakan bahawa kadmium mempunyai nombor atau keadaan pengoksidaan +2. Ini adalah nombor pengoksidaan utamanya. Sebagai contoh, sebatian berikut mengandungi kadmium sebagai +2: CDO (CD2+Sama ada2-), CDCL2 (CD2+Cl2-), Cdso4 (CD2+SW42-) dan CD (tidak3)2.
Sebagai tambahan kepada nombor pengoksidaan ini, terdapat juga +1 (CD+) dan -2 (cd2-). Nombor pengoksidaan +1 diperhatikan dalam pemisahan CD22+, di mana setiap atom kadmium mempunyai beban positif. Sementara itu, -2 agak pelik, dan akan memohon anion "kadmuro".
Di mana dan dapatkan
 Kristal Greenockita. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Kristal Greenockita. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Kadmium adalah elemen yang jarang berlaku yang mempunyai kepekatan 0.2 g / tan kerak bumi. Satu -satunya mineral kadmium penting ialah Greenockita (CDS), yang tidak dapat dieksploitasi dari pandangan perlombongan dan komersial.
Boleh melayani anda: pemberbukuan: tindak balas, jenis, aplikasi, contohKadmium dikaitkan dengan zink dalam mineral spheny (ZnS), yang biasanya mengandungi kepekatan yang berkisar antara 0.1 % dan 0.3 %; Tetapi dalam beberapa kes kepekatan kadmium dalam sphalerite dapat mencapai 1.4 %.
Batu yang diproses untuk mendapatkan baja fosforus boleh mempunyai kepekatan kadmium sebanyak 300 mg / kg baja. Batubara juga boleh mengandungi kadmium yang kecil, tetapi ketara.
Sumber penting kadmium adalah pelepasan gunung berapi yang boleh membawa kadmium ke perairan permukaan. Penggunaan baja fosforus di tanah penggunaan pertanian telah menyebabkan pencemaran kadmium.
Kadmium yang terdapat di tanah berasid dapat diserap oleh sayur -sayuran. Sebilangan sayur -sayuran digunakan oleh manusia sebagai makanan, yang menerangkan bagaimana pengambilan air dan makanan adalah sumber utama pendapatan kadmium pada orang yang tidak terdedah atau merokok.
Rawatan Sphalerite
Semasa perlombongan, peleburan dan penapisan zink yang terdapat di sphalerit, kadmium biasanya diperolehi sebagai produk sekunder. Acara yang sama juga berlaku, walaupun pada tahap yang lebih rendah, semasa pemprosesan tembaga dan plumbum.
Begitu juga, sejumlah kecil kadmium dapat diperoleh dari kitar semula besi dan sisa keluli.
Sprail tertakluk kepada roti bakar supaya zink sulfida menjadi oksida, ZnO. Reaksi yang sama dialami oleh kadmium sulfida:
2 Zns + 3 o2 → 2 zno + 2 jadi2
Jika campuran oksida ini dipanaskan dengan arang batu, mereka akan dikurangkan ke logam masing -masing:
ZnO + Co → Zn + Co2
Begitu juga, zink dan kadmium dapat dihasilkan oleh elektrolisis ketika melarutkan oksida dalam asid sulfurik.
Salah satu daripada kedua -dua kaedah menghasilkan lima puluh yang tercemar dengan kadmium. Apabila lebur, kadmium boleh disuling dalam vakum kerana titik lebur yang lebih rendah (321 ° C) berbanding dengan CINC (420 ° C).
Isotop
Di antara isotop semulajadi dan stabil kadmium yang kita ada, dengan kelimpahan masing -masing di bumi:
-106CD (1.25%)
-108CD (0.89%)
-110CD (12.47%)
-111CD (12.8%)
-112CD (24.11%)
-114CD (28.75%)
-113CD (12.23%)
Dia 113CD adalah radioaktif, tetapi disebabkan oleh nilai yang besar dari separuh kehidupannya (t1/2= 7.7 · 10lima belas tahun), boleh dianggap stabil. Dan kemudian ada 116CD, juga radioaktif, dengan separuh hayat 3.1 · 1019 tahun, jadi ia boleh dianggap sebagai isotop yang stabil, yang mewakili 7.51 % daripada kadmium.
Perhatikan bahawa purata jisim atom adalah 112,414 u, lebih dekat 112 daripada 114. Kewujudan isotop utama di atas yang lain tidak diperhatikan di kadmium.
Risiko
Umum
Penyerapan kadmium berlaku terutamanya oleh makanan, terutamanya hati, cendawan, kerang, koko serbuk dan alga kering.
Kes lambang berlaku di China pada abad yang lalu, di mana terdapat pencemaran penting dengan kadmium dalam populasi. Pencemaran kadmium disebabkan oleh kepekatannya yang tinggi dalam beras, disebabkan oleh kehadiran kadmium dalam tanah penanaman bijirin.
Perokok mempunyai pengambilan purata 60 μg / hari. Kepekatan maksimum kadmium yang dibenarkan dalam darah adalah 15 μg / hari. Bukan perokok mempunyai kepekatan kadmium dalam darah sekitar 0.5 μg / l.
Paru -paru menyerap antara 40 dan 60 % daripada kadmium yang terdapat dalam asap tembakau. Kadmium yang diserap di dalam paru -paru diangkut dalam darah, membentuk kompleks dengan protein, cysteine dan glutationa, yang kemudiannya berakhir di hati, buah pinggang, dll.
Penyedutan kadmium akut boleh menyebabkan gejala yang serupa dengan yang diperhatikan dalam proses selesema; seperti sejuk, demam dan sakit otot, dapat menyebabkan kerosakan paru -paru. Sementara itu, pendedahan kronik kepada kadmium boleh menyebabkan penyakit paru -paru, buah pinggang dan tulang.
Kesan pada buah pinggang
Di dalam buah pinggang, kadmium biasanya menyebabkan perubahan dalam metabolisme fosforus dan kalsium, dibuktikan dengan peningkatan pengeluaran pengiraan buah pinggang. Di samping itu, ia menyebabkan kerosakan buah pinggang yang ditunjukkan dalam penampilan dalam air kencing protein penghantar retinol dan β-2-microglobulin.
Kesan pembiakan
Pendedahan ibu kepada kadmium dikaitkan dengan berat badan rendah kanak -kanak semasa kelahiran dan peningkatan kadar pengguguran spontan.
Kerosakan tulang
Kadmium berkaitan di Jepun dengan kehadiran penyakit ITAI -Tiai pada abad yang lalu. Penyakit ini dicirikan oleh mineralisasi tulang yang rendah, kerapuhan tulang dengan kadar patah yang tinggi, peningkatan osteoporosis dan sakit tulang.
Boleh melayani anda: CD3: Ciri, FungsiKarsinogenesis
Walaupun eksperimen tikus mewujudkan hubungan antara kadmium dan kanser prostat, ia belum ditunjukkan pada manusia. Persatuan antara kadmium dan kanser buah pinggang telah dibuktikan, dan juga dikaitkan dengan kanser paru -paru.
Aplikasi
Bakteria yang boleh dicas semula Nickel-Cadmium
 Bateri yang berbeza atau bateri Ni-CD. Sumber: Boffy B melalui Wikipedia.
Bateri yang berbeza atau bateri Ni-CD. Sumber: Boffy B melalui Wikipedia. Kadmium hidroksida digunakan sebagai katod dalam bateri Ni-CD. Ini digunakan dalam industri kereta api dan aeronautik, serta instrumen untuk kegunaan kolektif yang termasuk telefon bimbit, camcorder, komputer riba, dll.
Penggunaan kadmium untuk penjelasan bateri Ni-CD mewakili 80 % pengeluaran kadmium. Walau bagaimanapun, disebabkan ketoksikan elemen ini, bateri Ni-CD telah secara beransur-ansur digantikan oleh bateri hidrida nikel-logam.
Pigmen
 Cadmium merah. Sumber: Marco Almbauer [domain awam]
Cadmium merah. Sumber: Marco Almbauer [domain awam] Kadmium sulfida digunakan sebagai pigmen kuning dan kadmium seleniuro sebagai pigmen merah, yang dikenali sebagai Cadmio Red. Pigmen ini dicirikan oleh kecemerlangan dan intensiti mereka, jadi mereka telah digunakan dalam plastik, seramik, kaca, enamel dan warna artistik.
Telah dinyatakan bahawa pelukis Vincent Van Gogh menggunakan pigmen kadmium dalam lukisannya, yang membolehkannya mencapai pelbagai warna merah, oren dan terang.
Pewarna pigmen kadmium mesti dilemahkan sebelum menjadi tanah dengan minyak atau dicampur dengan cat air dan akrilik.
Televisyen
Komponen yang mengandungi kadmium digunakan dalam fosforus televisyen hitam dan putih, serta dalam perlawanan biru dan hijau untuk tiub imej televisyen warna.
Fosforus adalah sebahagian daripada skrin yang dipancarkan oleh sinar katod, yang bertanggungjawab untuk pembentukan imej. Kadmium, walaupun ketoksikannya, telah mula digunakan pada televisyen QLED penciptaan baru -baru ini.
Penstabilan PVC
Sebatian kadmium yang dibentuk dengan karboksilat, pensianya dan steereate digunakan sebagai penstabil polyvinyl chloride, kerana mereka melambatkan kemerosotan yang dihasilkan oleh pendedahan kepada haba dan cahaya ultraviolet yang memecah PVC semasa proses pembuatannya.
Oleh kerana ketoksikan kadmium, sekali lagi, penstabil PVC bersatu dengan kadmium telah digantikan oleh penstabil lain, seperti barium, kalsium-zink dan organostaño.
Aloi
Kadmium telah digunakan dalam aloi galas kerana rintangan yang tinggi terhadap keletihan dan pekali geseran yang rendah. Kadmium mempunyai titik lebur yang agak rendah, jadi ia digunakan dalam aloi yang rendah, dan merupakan komponen sebagai tambahan kepada banyak jenis kimpalan.
Kadmium juga boleh digunakan dalam aloi kekonduksian elektrik, kekonduksian terma dan hubungan elektrik.
Penutup
Kadmium digunakan untuk perlindungan keluli, aluminium dan lain. Perlindungan Salutan Kadmium Perlindungan Kakisan di Media Saline dan Alkali. Di samping itu, ia berfungsi sebagai pelincir.
Kadmium juga digunakan dalam banyak aplikasi elektrik dan elektronik yang memerlukan rintangan kakisan dan ketahanan elektrik yang rendah.
Reaktor nuklear
Kadmium digunakan dalam reaktor nuklear untuk keupayaan mereka untuk menangkap neutron, yang membolehkan untuk mengawal produk neutron berlebihan pembelahan nuklear, mengelakkan celah nuklear tambahan.
Semikonduktor
Seleniuro dan kadmium telluriuro adalah sebatian yang memenuhi fungsi semikonduktor dalam pengesanan cahaya dan sel solar. HGCDTE sensitif terhadap cahaya inframerah dan digunakan sebagai pengesan pergerakan, serta suis untuk peranti kawalan jauh.
Biologi
 He-CD Laser Light. Sumber: agak tanpa nama (https: // www.Flickr.com/foto/[E -mel Protect]/35766549)
He-CD Laser Light. Sumber: agak tanpa nama (https: // www.Flickr.com/foto/[E -mel Protect]/35766549) Helium-CD campur tangan dalam pembentukan rasuk laser biru-violet panjang gelombang yang berkisar antara 325 dan 422 nm, boleh digunakan dalam mikroskop pendarfluor.
Kadmium digunakan dalam biologi molekul untuk menyekat saluran kalsium, bergantung kepada potensi membran.
Rujukan
- Wikipedia. (2019). Kadmium. Diperoleh dari: dalam.Wikipedia.org
- Hutan v. R. & et al. (2014). Tekanan tinggi dan struktur suhu cecair dan pepejal CD: Implikasi untuk lengkung lebur CD. Pulih dari: Penyelidikan.jaring
- Dr. Dough Stewart. (2019). Fakta elemen kadmium. Pulih dari: chemicool.com
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Kadmium. Pangkalan data PUBCHEM. CID = 23973. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Godt, j., Scheidig, f., Grosse-Siestup, c., Esche, v., Brandenburg, ms., Reich, a., & Groneberg, D. Ke. (2006). Ketoksikan kadmium dan bahaya yang dihasilkan untuk kesihatan manusia. Jurnal Perubatan dan Toksikologi Pekerjaan (London, England), 1, 22. Doi: 10.1186/1745-6673-1-22
- Ros Rachel. (30 Julai 2018). Fakta mengenai Camium. Pulih dari: Livescience.com
- Editor enyclopaedia Britannica. (6 September 2018). Kadmium. Encyclopædia Britannica. Pulih dari: Britannica.com
- Persatuan Cadmium Antarabangsa. (s.F.). Aplikasi kadmium. Pulih dari: kadmium.org
- Lentech b. V. (2019). Kadmium. Pulih dari: lentech.com
- « Fungsi nod basal, anatomi dan patologi
- Parasitologi Sejarah, Apa yang Anda Kaji?, Cawangan, konsep »

