Perubahan jenis keadaan dan ciri -ciri mereka (dengan contoh)
- 2580
- 230
- Horace Gulgowski
The keadaan perubahan atau fasa adalah fenomena termodinamik di mana perkara pengalaman berubah berubah fizikal. Dikatakan bahawa ia adalah termodinamik kerana pemindahan haba berlaku antara bahan dan persekitaran; Atau apa yang sama, terdapat interaksi antara bahan dan tenaga yang mendorong penyusunan semula zarah.
Zarah yang mengalami perubahan status tetap sama sebelum dan selepas yang sama. Tekanan dan suhu adalah pembolehubah penting dalam bagaimana ini ditempatkan dalam satu fasa atau yang lain. Apabila perubahan keadaan berlaku, sistem biphasic terbentuk, terdiri daripada perkara yang sama dalam dua keadaan fizikal yang berbeza.
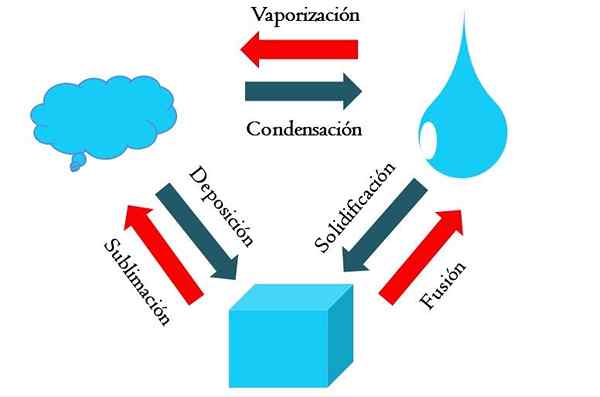
 Keadaan perubahan. Sumber: Gabriel Bolívar
Keadaan perubahan. Sumber: Gabriel Bolívar Imej yang lebih tinggi menunjukkan perubahan utama keadaan yang penting dalam keadaan normal.
Kubus pepejal bahan kebiruan boleh menjadi cecair atau gas bergantung pada suhu dan tekanan persekitarannya. Dengan sendirinya ia mewakili satu fasa: pepejal. Tetapi, pada masa lebur, iaitu, cair, keseimbangan pepejal yang dipanggil fusion (anak panah merah antara baldi dan penurunan biru ditubuhkan).
Untuk membuat gabungan berlaku, kiub perlu menyerap haba dari persekitarannya untuk meningkatkan suhunya; Oleh itu, ia adalah proses endotermik. Setelah kiub cair, sekali lagi fasa tunggal: keadaan cecair.
Blota ini dapat terus menyerap haba, yang meningkatkan suhunya dan menimbulkan pembentukan gelembung gas. Sekali lagi, terdapat dua fasa: satu cecair dan soda lain. Apabila semua cecair telah menguap melalui titik mendidihnya, kemudian dikatakan bahawa ia telah direbus atau menguap.
Sekarang, titisan kebiruan berubah menjadi awan. Setakat ini, semua proses telah menjadi endotermal. Gas kebiruan boleh terus menyerap haba sehingga dipanaskan; Walau bagaimanapun, memandangkan keadaan terestrial, ini sebaliknya cenderung menyejukkan dan memeluk lagi dalam cecair (pemeluwapan).
Sebaliknya, awan juga boleh didepositkan secara langsung dalam fasa pepejal, membentuk kiub pepejal sekali lagi (pemendapan). Kedua -dua proses terakhir ini adalah eksotermik (anak panah biru); iaitu, mereka melepaskan haba ke persekitaran atau sekitar.
Sebagai tambahan kepada pemeluwapan dan pemendapan, terdapat perubahan keadaan apabila blota membeku pada suhu rendah (pemejalan).
[TOC]
Jenis perubahan keadaan dan ciri -ciri mereka
Imej menunjukkan perubahan tipikal untuk keadaan tiga (paling biasa) perkara: pepejal, cecair dan gas. Perubahan yang disertai oleh anak panah merah adalah endotermik, mereka menyiratkan penyerapan haba; Sementara yang diiringi oleh anak panah biru adalah eksotermik.
Penerangan ringkas mengenai setiap perubahan ini akan dibuat di bawah, menonjolkan beberapa ciri -cirinya dari penalaran molekul dan termodinamik.
- Fusion
Fusion adalah perubahan keadaan bahan dari keadaan pepejal ke cecair.

Dalam keadaan pepejal zarah (ion, molekul, kelompok, dll.) adalah "tahanan", yang terletak di kedudukan tetap ruang tanpa dapat bergerak dengan bebas. Walau bagaimanapun, mereka dapat bergetar pada frekuensi yang berbeza, dan jika ini sangat kuat, perintah yang ketat yang dikenakan oleh daya intermolecular akan mula "runtuh.
Akibatnya, dua fasa diperolehi: satu di mana zarah terus terkurung (pepejal), dan satu lagi di mana mereka lebih bebas (cecair), cukup untuk meningkatkan jarak yang memisahkannya dari satu sama lain. Untuk mencapai matlamat ini, pepejal mesti menyerap haba, dan oleh itu zarah -zarahnya akan bergetar dengan daya yang lebih besar.
Ia boleh melayani anda: jisim atom: definisi, jenis, cara mengira, contohnyaAtas sebab ini gabungan endotermik, dan apabila ia bermula, dikatakan bahawa keseimbangan antara fasa pepejal berlaku.
Haba yang diperlukan untuk menimbulkan perubahan ini dipanggil entalpi panas atau lebur (ΔHFus). Ini menyatakan jumlah haba (tenaga, dalam unit KJ terutamanya) yang mesti menyerap mol bahan pepejal untuk mencairkan, dan bukan hanya menaikkan suhunya.
Bola salji
 Lebur salji dengan tangan. Sumber: Pixabay
Lebur salji dengan tangan. Sumber: Pixabay Dengan ini, difahami mengapa bola salji cair di tangan (imej unggul). Salji menyerap haba badan, yang cukup untuk menaikkan suhu salji di atas 0 ° C.
Kristal ais yang terdapat di salji menyerap haba yang betul untuk mencairkan dan supaya molekul air mereka mengamalkan struktur yang lebih tidak senonoh. Walaupun salji cair, air yang terbentuk tidak akan meningkatkan suhunya, kerana semua haba tangan mengambil kesempatan dari salji untuk menyelesaikan gabungannya.
- Pengewapan

Pengewapan adalah perubahan keadaan bahan dari keadaan cecair ke gas.
Meneruskan dengan contoh air, kini meletakkan segelintir salji di dalam periuk dan menyalakan api, diperhatikan bahawa salji cepat cair. Apabila air dipanaskan, gelembung karbon dioksida kecil dan lain -lain kemungkinan kekotoran gas mula terbentuk.
 Air mendidih. Sumber: Pixabay
Air mendidih. Sumber: Pixabay Haba diluaskan secara molekul konfigurasi air yang tidak senonoh, mengembangkan jumlahnya dan meningkatkan tekanan stimnya; Oleh itu, terdapat beberapa molekul yang melarikan diri dari produk permukaan yang semakin meningkat.
Air cecair meningkatkan suhunya perlahan -lahan, kerana haba spesifiknya yang tinggi (4,184j/° C ∙ g) g). Terdapat satu titik di mana haba yang menyerap tidak lagi menggunakannya untuk menaikkan suhunya, tetapi untuk memulakan keseimbangan cecair-wap; Iaitu, ia mula mendidih dan semua cecair akan lulus ke keadaan gas semasa menyerap haba dan mengekalkan suhu pemalar.
Di sinilah gelembung sengit diperhatikan di permukaan air rebus (imej unggul). Haba yang menyerap air cair supaya tekanan wap gelembung awalnya sama dengan tekanan luaran, dipanggil entalpi pengewapan (ΔHVap).
Peranan tekanan
Tekanan juga tegas dalam perubahan keadaan. Apakah kesannya terhadap pengewapan? Bahawa pada tekanan yang lebih besar, semakin besar haba yang mesti menyerap air hingga mendidih, dan oleh itu, ia dikurangkan melebihi 100 ° C.
Ini kerana peningkatan tekanan menjadikannya sukar untuk melarikan diri dari molekul air dari fasa cecair ke soda.
Pot tekanan menggunakan fakta ini memihak kepada mereka untuk memanaskan makanan di dalam air pada suhu di atas titik mendidih mereka.
Sebaliknya, mempunyai vakum atau penurunan tekanan, air cair memerlukan suhu yang lebih rendah untuk mendidih dan bergerak ke fasa gas. Dengan tekanan yang banyak atau sedikit, pada masa mendidih air perlu menyerap haba pengewapan masing -masing untuk menyelesaikan perubahan keadaannya.
- Pemeluwapan
Pemeluwapan adalah perubahan keadaan bahan dari keadaan gas ke keadaan cecair.
Dapat melayani anda: galaktosa
Air telah menguap. Apa yang akan datang? Wap air masih boleh meningkatkan suhunya, menjadi arus berbahaya yang mampu menyebabkan luka bakar serius.
Namun, sebaliknya anggap ia menyejukkan. Sebagai? Melepaskan haba ke alam sekitar, dan apabila dibebaskan haba dikatakan bahawa proses eksotermik sedang berlaku.
Dengan melepaskan haba, molekul gas tenaga mula melambatkan. Juga, interaksinya mula menjadi lebih berkesan apabila suhu stim turun. Pertama, titisan air, kondensat stim, diikuti dengan titisan yang lebih besar yang akhirnya tertarik dengan graviti akan dibentuk.
Untuk sepenuhnya mengikat sejumlah stim, anda perlu melepaskan tenaga yang sama, tetapi dengan tanda bertentangan, di ΔHVap; iaitu, entalpi pemeluwapan ΔHCond. Oleh itu, keseimbangan terbalik, stim cecair stabil.
Tingkap yang dibasahi
 Pemeluwapan air. Sumber: Pexels
Pemeluwapan air. Sumber: Pexels Pemeluwapan dapat diperhatikan di tingkap isi rumah sendiri. Dalam cuaca sejuk, wap air yang terkandung di dalam rumah bertembung dengan tingkap, yang oleh bahannya mempunyai suhu yang lebih rendah daripada permukaan lain.
Di sana, lebih mudah untuk molekul stim untuk berkumpulan, mewujudkan lapisan putih nipis dengan mudah dilepaskan dengan tangan. Oleh kerana molekul ini melepaskan haba (kaca pemanasan dan udara), mereka mula membentuk lebih banyak kelompok sehingga mereka dapat mengekang titisan pertama (imej atas).
Apabila titisan sangat meningkatkan saiz mereka, mereka meluncur melalui tingkap dan meninggalkan jejak air.
- Pemejalan
Pemejalan adalah perubahan keadaan bahan dari keadaan cecair ke keadaan pepejal.

Pemejalan berlaku kerana penyejukan; Dengan kata lain, air membeku. Untuk membeku, air mesti melepaskan jumlah haba yang sama yang menyerap ais untuk mencairkan. Sekali lagi, haba ini dipanggil pemejalan atau entalpi pembekuan, ΔHCong (-ΔHFus).
Apabila penyejukan, molekul air kehilangan tenaga dan interaksi intermolecular mereka menjadi lebih kuat dan lebih berarah. Akibatnya, mereka diperintahkan terima kasih kepada jambatan hidrogen mereka dan membentuk kristal ais. Mekanisme di mana kristal ais memberi kesan kepada penampilan mereka: telus atau putih.
 Patung ais. Sumber: Pixabay
Patung ais. Sumber: Pixabay Sekiranya kristal ais tumbuh dengan perlahan, ini tidak menyekat kekotoran, seperti gas yang pada suhu rendah diselesaikan di dalam air. Oleh itu, gelembung melarikan diri dan tidak dapat berinteraksi dengan cahaya; Dan akibatnya, terdapat ais yang telus seperti patung ais yang luar biasa (imej unggul).
Sama yang berlaku dengan ais, boleh berlaku dengan bahan lain yang menguatkan dengan penyejukan. Mungkin ini adalah perubahan fizikal yang paling kompleks dalam keadaan terestrial, kerana beberapa polimorf dapat diperoleh.
- Sublimasi
Sublimasi adalah perubahan keadaan bahan dari pepejal ke gas.

Boleh air sublim? Tidak, sekurang -kurangnya tidak dalam keadaan normal (t = 25 ° C, p = 1 atm). Untuk sublimasi berlaku, iaitu perubahan keadaan pepejal gas, tekanan wap pepejal mesti tinggi.
Begitu juga, adalah penting bahawa daya intermolecular mereka tidak begitu kuat, sebaiknya jika mereka hanya terdiri daripada daya penyebaran
Contoh yang paling lambang adalah yodin pepejal. Ia adalah pepejal kristal nada kelabu-moral, yang mempunyai tekanan stim tinggi. Begitu juga, dalam perbuatannya, wap ungu berikut, yang jumlah dan pengembangannya terkenal ketika dia berada di bawah pemanasan.
Boleh melayani anda: triethilamine: struktur, sifat, kegunaan dan risiko Sublimasi iodin. Sumber: Belkina N V [CC oleh 4.0 (https: // creativeCommons.Org/lesen/by/4.0)], dari Wikimedia Commons
Sublimasi iodin. Sumber: Belkina N V [CC oleh 4.0 (https: // creativeCommons.Org/lesen/by/4.0)], dari Wikimedia Commons Dalam imej atas percubaan biasa ditunjukkan di mana iodin pepejal menguap dalam bekas kaca. Sangat menarik dan menarik untuk memerhatikan bagaimana wap ungu disebarkan, dan pelajar yang dimulakan dapat mengesahkan ketiadaan iodin cecair.
Ini adalah ciri utama penyangak: tidak ada kehadiran fasa cair. Ia juga endotermik, kerana pepejal menyerap haba untuk meningkatkan tekanan stimnya sama dengan tekanan luaran.
- Pemendapan
 IODO Crystal Depposition. Sumber: Stanislav.Nevyhosteny [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons
IODO Crystal Depposition. Sumber: Stanislav.Nevyhosteny [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons Pemendapan adalah perubahan keadaan bahan dari keadaan gas ke keadaan pepejal.
Selari dengan eksperimen sublimasi iodin, anda mempunyai pemendapan bahawa. Pemendapan adalah perubahan atau peralihan yang bertentangan: Bahan berlalu dari keadaan gas ke pepejal tanpa pembentukan fasa cair.
Apabila wap ungu iodin bersentuhan dengan permukaan yang sejuk, mereka melepaskan haba untuk memanaskannya, kehilangan tenaga dan mengumpulkan semula molekul mereka lagi dalam pepejal kelabu-kelabu (imej unggul). Ia adalah proses eksotermik.
Pemendapan digunakan secara meluas untuk sintesis bahan di mana mereka doping dengan atom logam melalui teknik canggih. Sekiranya permukaannya sangat sejuk, pertukaran haba di antaranya dan zarah stim tiba -tiba, tidak menghilangkan laluan melalui fasa cecair masing -masing.
Panas atau entalpi pemendapan (dan tidak Pemendapan) adalah sublimasi (ΔHSub=- ΔHD.E.P). Secara teorinya, banyak bahan boleh disahlin, tetapi untuk mencapai ini adalah perlu untuk memanipulasi tekanan dan suhu, selain mempunyai rajah p vs t di tangan; di mana, fasa jauh mereka boleh digambarkan.
Perubahan keadaan lain
Walaupun mereka tidak disebutkan, ada keadaan lain. Kadang -kadang mereka dicirikan dengan mempunyai "sedikit masing -masing", dan oleh itu gabungan mereka. Untuk menjana mereka, tekanan dan suhu harus dimanipulasi kepada magnitud yang sangat positif (besar) atau negatif (kecil).
Oleh itu, sebagai contoh, jika gas dipanaskan, mereka akan kehilangan elektron mereka dan nukleus yang dimuatkan secara positif dalam arus negatif itu akan menjadi apa yang dikenali sebagai plasma. Ia adalah sinonim untuk "gas elektrik", kerana ia membentangkan kekonduksian elektrik yang tinggi.
Sebaliknya, apabila suhu turun terlalu banyak, perkara boleh menjadi tidak disangka -sangka; iaitu, mereka mempamerkan sifat unik sekitar sifar mutlak (0 k).
Salah satu sifat ini adalah superfluousness dan superconductivity; serta pembentukan Bose-Einstein Condensate, di mana semua atom berkelakuan sebagai satu.
Malah beberapa siasatan menunjukkan perkara fotonik. Di dalamnya zarah radiasi elektromagnet, foton, dikelompokkan untuk membentuk molekul fotonik. Iaitu, ia akan memberi jisim kepada beberapa badan cahaya, secara teorinya.
Rujukan
- Helmestine, Anne Marie, Ph.D. (19 November 2018). Senarai perubahan fasa antara keadaan perkara. Pulih dari: Thoughtco.com
- Wikipedia. (2019). Keadaan perkara. Diperoleh dari: dalam.Wikipedia.org
- Dorling Kindersley. (2007). Menukar keadaan. Pulih dari: factmonster.com
- Meyers Ami. (2019). Perubahan fasa: penyejatan, pemeluwapan, pembekuan, lebur, sublimasi & pemendapan. Kajian. Pulih dari: belajar.com
- Bagley m. (11 April 2016). Perkara: definisi & lima keadaan perkara. Pulih dari: Livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- « Undang -undang kedua formula termodinamik, persamaan, contoh
- Struktur, Kiodida (KI) Struktur, Hartanah, Mendapatkan, Risiko, Risiko, »

