Struktur, Kiodida (KI) Struktur, Hartanah, Mendapatkan, Risiko, Risiko,

- 1106
- 111
- Ms. Santos Fritsch
Dia Potassium iodide Ia adalah sebatian bukan organik yang dibentuk oleh ion kalium (k+) dan ion iodida (i-). Formula kimianya adalah ki. Ia adalah pepejal kristal putih, sifat ionik dan sangat larut dalam air.
Ki membolehkan beberapa tindak balas dan analisis kimia dan digunakan untuk mengukur jumlah ozon di atmosfera. Ia juga digunakan dalam Peralatan Analisis Inframerah (IR).
 Pepejal ki kalium iodida. Ondřej Mangl [domain awam]. Sumber: Wikimedia Commons.
Pepejal ki kalium iodida. Ondřej Mangl [domain awam]. Sumber: Wikimedia Commons. Potassium iodida ditambah ke garam meja biasa untuk mengelakkan kekurangan iodin pada orang, kerana ini dapat menjadi masalah kesihatan yang serius.
Ia digunakan sebagai expectorant kerana ia membantu lendir dapat mengalir dengan mudah dari saluran pernafasan di luar. Ia juga berfungsi untuk merawat beberapa jangkitan kulat dan digunakan dalam beberapa kosmetik.
Ia digunakan oleh doktor veterinar untuk menyembuhkan haiwan masalah yang serupa dengan manusia, seperti batuk dan jangkitan kulit. Ia juga ditambah dalam jumlah yang sangat kecil untuk haiwan untuk haiwan.
[TOC]
Struktur
Potassium Iodide adalah sebatian ionik yang dibentuk oleh kation kalium k+ Dan anion yoduro i-, Oleh itu, di antara mereka pautan adalah ionik. Status pengoksidaan kalium adalah +1 dan valencia del iodine adalah -1.
 Potassium Iodide adalah sebatian ionik. Pengarang: Marilú Stea.
Potassium Iodide adalah sebatian ionik. Pengarang: Marilú Stea. Kristal Ki Potassium Iodide adalah padu.
 Struktur Ki Potassium Iodide. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons.
Struktur Ki Potassium Iodide. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons. Nomenclature
- Potassium iodide
- Potassium iodide
Sifat
Keadaan fizikal
Pepejal putih kristal. Kristal padu.
Berat molekul
166,003 g/mol
Takat lebur
681 ºC
Takat didih
1323 ºC
Ketumpatan
3.13 g/cm3
Kelarutan
Sangat larut dalam air: 149 g/100 g air pada suhu 25 ° C. Sedikit larut dalam etanol dan eter.
Boleh melayani anda: neon: sejarah, sifat, struktur, risiko, kegunaanPh
Penyelesaian berairnya adalah neutral atau alkali, dengan pH antara 7 dan 9.
Sifat kimia
Sedikit hygroscopic di udara lembap.
Ia stabil di udara kering. Cahaya dan kelembapan mempercepatkan penguraiannya dan warna berubah menjadi kuning disebabkan oleh pelepasan sejumlah kecil yodium (i2) dan yodatos (io3-).
Penyelesaian berair ki juga menjadi kuning dari masa ke masa, bagaimanapun, dengan sedikit alkali ini dapat dielakkan.
Penyelesaian ini larut ke iodin (i2) Memberi ki3:
Yo- + Yo2 → i3-
Sifat lain
Ia mempunyai rasa yang sangat pahit dan garam. Ia tidak mudah terbakar.
Memperoleh
Potassium iodide boleh didapati dengan pemanasan yodium (i2) Dalam larutan pekat kalium hidroksida (KOH):
3 i2 + 6 koh → 5 ki + kio3 + H2Sama ada
Penyelesaian Yodato dan iodida yang dihasilkan dipanaskan untuk menghapuskan air, dikurangkan kepada kekeringan, arang batu ditambah dan dipanaskan pada suhu tinggi. Batu arang mengambil oksigen dari iodate dan mengoksidakan karbon dioksida sehingga mengurangkan iodida ke iodida:
2 kio3 + C → 2 ki + 3 co2
Potassium iodide yang diperolehi dapat direkrut semula untuk membersihkannya. Iaitu, ia ditemui semula di dalam air dan mendorong untuk mengkristal lagi.
Aplikasi
Dalam rawatan hipertiroidisme
Potassium Iodide berfungsi sebagai rawatan tambahan bersama -sama dengan agen antithyroid lain untuk merawat hipertiroidisme.
Hyperthyroidism adalah penyakit yang menyebabkan kelenjar tiroid menghasilkan terlalu banyak hormon tiroid, dengan peningkatan saiz tiroid, menurunkan berat badan, degupan jantung dan kerengsaan yang dipercepatkan, antara gejala lain.
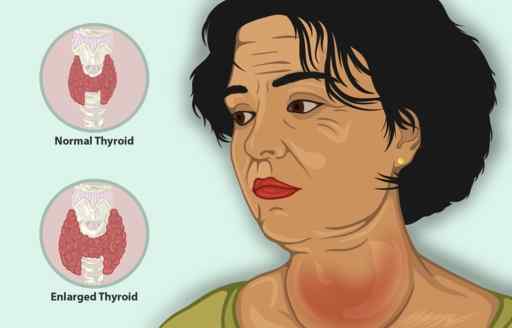 Wanita dengan tiroid yang meradang. Ia boleh dirawat dengan ki kalium iodida. https: // www.Myupchar.com/in [cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Wanita dengan tiroid yang meradang. Ia boleh dirawat dengan ki kalium iodida. https: // www.Myupchar.com/in [cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Pada pesakit dengan hipertiroidisme, Ki dengan cepat mengurangkan gejala kerana ia menghalang pembebasan hormon tiroid.
Kesan tiroidnya adalah: menurunkan jumlah saluran darah kelenjar, mengesahkan semula tisu mereka dan menurunkan saiz sel mereka.
Atas sebab ini ia terpakai sebagai rawatan praoperasi untuk mendorong penyebaran atau penurunan saiz tiroid sebelum tiroidektomi (penyingkiran tiroid) kerana operasi ini difasilitasi.
Boleh melayani anda: natrium: sejarah, struktur, sifat, risiko dan kegunaanDalam aplikasi perubatan lain
Potassium Iodide mempunyai sifat expectorant sebagai rembesan cecair pernafasan meningkat, mengakibatkan kelikatan lendir menurun.
 Potassium Iodide boleh bertindak sebagai expectorant dalam rawatan batuk. Pengarang: аball г г г. Sumber: Pixabay.
Potassium Iodide boleh bertindak sebagai expectorant dalam rawatan batuk. Pengarang: аball г г г. Sumber: Pixabay. Ia berfungsi untuk rawatan erythema nodoso, yang merupakan keradangan yang menyakitkan di kaki di mana nodul merah dan peningkatan suhu terbentuk.
Adalah ejen antihongos. Ia membolehkan merawat sporotrosis yang merupakan jangkitan kulit yang disebabkan oleh kulat. Penyakit ini berlaku kepada orang yang bekerja dengan tumbuh -tumbuhan dan tanah, seperti petani dan tukang kebun.
Ia juga digunakan dalam rawatan kekurangan iodin atau untuk mengelakkannya dan oleh itu menambah garam meja atau garam yang boleh dimakan (natrium klorida NaCl) sebagai sumber yodium dan kadang -kadang di dalam air untuk minum.
Dalam aplikasi veterinar
Potassium iodida diberikan kepada haiwan sebagai antitustive, untuk meningkatkan dan mencairkan cecair saluran pernafasan, untuk batuk kronik bronkial, serta dalam kes rheumatisme dan sebagai anti -radang.
Ia juga berfungsi untuk mycosis (jangkitan kulat) haiwan, untuk mengurangkan gatal -gatal dan keracunan kronik atau keracunan merkuri.
Dalam perlindungan kelenjar tiroid dalam kecemasan radioaktif
Potassium Iodide mempunyai sifat perlindungan tiroid sekiranya orang itu telah terdedah kepada radiasi nuklear.
Ki membanjiri tiroid dengan iodin bukan -radioaktif dengan itu menyekat pengambilan molekul radioaktif dan penyerapan yodium radioaktif, melindungi kelenjar tiroid dari kanser yang boleh menyebabkan radiasi.
Dalam langkah ozon di atmosfera
Gas ozon (atau3) Ia boleh diukur di atmosfera menggunakan sel -sel elektrolitik yang dipanggil ozonosandas, yang diangkut oleh belon radiosondas.
Boleh melayani anda: Benchilo BenzoateSel -sel elektrolitik ini mengandungi penyelesaian iodida Ki Ki. Sel pada mulanya dalam keseimbangan kimia dan elektrik.
Apabila sampel udara dengan ozon (atau3) Menembusi salah satu sel keseimbangan rosak kerana tindak balas berikut berlaku:
2 ki + atau3 + H2O → i2 + Sama ada2 + 2 Koh
Reaksi ini menghasilkan arus elektrik yang mengalir di antara sel.
Jumlah arus elektrik yang dihasilkan terus dihantar melalui gelombang radio ke stesen di darat. Dengan cara ini profil ozon yang dari tanah ke ketinggian bola diperolehi.
 Belon mengambil -dengan radiosonda dengan ki untuk mengukur ozon. Hannes Grobe 19:27, 20 Jun 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Jerman [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/2.5)]. Sumber: Wikimedia Commons.
Belon mengambil -dengan radiosonda dengan ki untuk mengukur ozon. Hannes Grobe 19:27, 20 Jun 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Jerman [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/2.5)]. Sumber: Wikimedia Commons. Dalam beberapa kegunaan
Potassium Iodide juga membenarkan:
- Penghapusan radikal bebas seperti radikal hidroksil OH.
- Pembuatan emulsi fotografi, untuk mendakan perak.
- Meningkatkan makanan haiwan apabila ditambah dalam mikrokontiti.
- Deodorize baja lembu.
- Menghantar lampu spektrum inframerah dalam peralatan analisis IR.
- Lakukan tindak balas dan analisis kimia tertentu dalam makmal kimia.
- Gunakannya dalam produk kebersihan peribadi.
- Lakukan analisis pencemaran alam sekitar.
Risiko
Sebilangan orang sensitif terhadap iodida.
Orang yang mempunyai tuberkulosis atau bronkitis akut juga harus berhati -hati.
Ki boleh menyebabkan melembutkan kelenjar air liur, ia boleh membakar mulut atau tekak, peningkatan yang tidak biasa dalam air liur, sakit gigi dan keradangan gusi dan rasa logam, antara gejala lain.
Anda juga boleh merengsakan mata dan membuka luka pada kulit.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Potassium iodide. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Kirk-Othmer (1994). Ensiklopedia Teknologi Kimia. Edisi keempat. John Wiley & Sons.
- Dekan, J.Ke. (editor). (1973). Buku Panduan Kimia Lange. Edisi Elementh. Syarikat Buku McGraw-Hill.
- Valkovic, v. (2019). Dekontaminasi selepas pendedahan radiasi. Bahagian badan yang paling sensitif. Dalam Radioaktiviti di Alam Sekitar (Edisi Kedua). Pulih dari Scientedirect.com.
- Smit, h.G.J. (2015). Kimia Observasi Atmosfera untuk Kimia (in situ). Dalam Ensiklopedia Sains Atmosfera (edisi kedua). Pulih dari Scientedirect.com.
- Muralikrishna, i.V. dan Manickam, v. (2017). Kaedah Analisis untuk Memantau Pencemaran Alam Sekitar. Dalam Pengurusan Alam Sekitar. Pulih dari Scientedirect.com.
- Wallace, J.M. dan Hobbs, p.V. (2006). Kimia Atmosfera 1. Dalam Sains Atmosfera (edisi kedua). Pulih dari Scientedirect.com.
- « Perubahan jenis keadaan dan ciri -ciri mereka (dengan contoh)
- Konsep, contoh dan jenis penurunan »

