Lapisan Valencia
- 1208
- 256
- Dallas Bernhard
 Lapisan Valencia adalah di mana tindak balas kimia berlaku
Lapisan Valencia adalah di mana tindak balas kimia berlaku Apakah lapisan Valencia?
The Lapisan Valencia Ia adalah elektron yang bertanggungjawab terhadap sifat kimia unsur. Elektron dalam lapisan ini berinteraksi dengan atom jiran, untuk membentuk ikatan kovalen (A-B); Dan jika mereka berhijrah dari satu atom ke satu lagi elektronegatif, pautan ionik (A+B-).
Lapisan ini ditakrifkan oleh nombor kuantum utama n, yang seterusnya menunjukkan tempoh di mana elemen terletak di dalam jadual berkala. Walaupun pesanan oleh kumpulan bergantung kepada bilangan elektron yang mengorbit di lapisan Valencia.
Jadi itu untuk a n Sama dengan 2, anda boleh menduduki lapan elektron: lapan kumpulan (1-8).
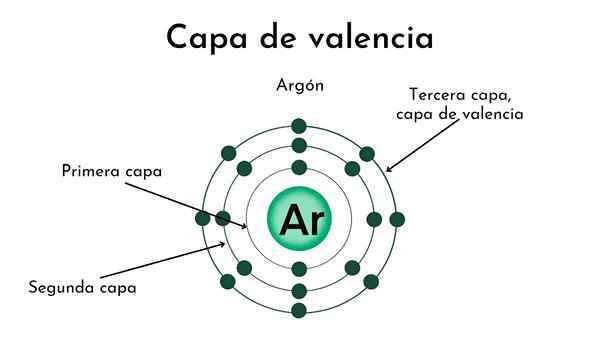
 Nukleus atom dengan empat lapisan. Sumber: Gabriel Bolívar
Nukleus atom dengan empat lapisan. Sumber: Gabriel Bolívar Di bahagian atas dan penutup makna lapisan Valencia digambarkan. Titik hitam di tengah atom adalah nukleus, manakala lingkaran sepusat yang selebihnya adalah lapisan elektronik yang ditakrifkan oleh n.
Berapa banyak lapisan yang ada atom ini? Setiap daripada mereka mempunyai warna tersendiri, dan apabila terdapat empat, maka atom mempunyai empat lapisan (n= 4).
Perhatikan bahawa warna itu merendahkan kerana jarak dari lapisan meningkat ke nukleus. Lapisan Valencia adalah yang jauh dari nukleus: warna yang paling jelas.
Apakah lapisan Valencia?
Menurut imej, lapisan Valencia tidak lebih daripada orbital terakhir atom yang diduduki oleh elektron. Di lapisan biru muda, untuk n= 4 Terdapat siri 4S, 4P, 4D dan 4F orbital; iaitu, di dalamnya terdapat sub -syarikat lain dengan keupayaan elektronik yang berbeza.
Atom memerlukan elektron untuk mengisi semua orbital 4n. Proses ini dapat dilihat dalam konfigurasi elektronik unsur -unsur dalam tempoh.
Boleh melayani anda: Alkanes linear: struktur, sifat, nomenclature, contohSebagai contoh, kalium mempunyai konfigurasi elektronik [AR] 4S1, Semasa kalsium, di sebelah kanan anda, [AR] 4S2.
Menurut konfigurasi ini, apakah lapisan Valencia? Istilah [ar] merujuk kepada konfigurasi elektronik gas argon 1s yang mulia22s22 p63s23p6. Ini mewakili lapisan dalaman atau tertutup (yang juga dikenali sebagai Kernel).
Oleh kerana orbital 4s adalah yang mempunyai tenaga terbesar, dan di mana elektron baru masuk, ia mewakili lapisan valensi untuk kedua -dua k dan ca. Jika atom K dan Ca dibandingkan dengan imej, [ar] akan menjadi semua lapisan dalaman biru; dan 4s lapisan biru muda, luaran.
Ciri -ciri lapisan Valencia
Dari atas, beberapa ciri lapisan Valencia boleh diringkaskan untuk semua atom:
-Tahap tenaganya lebih tinggi; Apa yang sama, lebih banyak ditarik balik dari nukleus dan mempunyai ketumpatan elektronik yang paling rendah (berbanding dengan lapisan lain).
-Ia tidak lengkap. Oleh itu, ia akan terus diisi dengan elektron sebagai tempoh dari kiri ke kanan sedang dalam perjalanan dalam jadual berkala.
-Campur tangan dalam pembentukan kovalen atau pautan ionik.
Dalam kes logam kalium dan kalsium, mereka mengoksida untuk berubah menjadi kation. K+ Ia mempunyai konfigurasi elektronik [AR], kerana ia kehilangan elektron luaran sahaja 4S1. Dan di sisi CA2+, Konfigurasinya juga [AR]; Kerana bukannya kehilangan elektron, ia kehilangan dua (4s2).
Tetapi apakah perbezaan antara k+ dan ca2+, Jika kedua -duanya kehilangan elektron lapisan valensi mereka dan mempunyai konfigurasi elektronik [AR]? Perbezaannya dalam radio ioniknya.
Boleh melayani anda: Mercury Oxide (HG2O)Ac2+ lebih kecil daripada k+ Kerana atom kalsium mempunyai proton tambahan yang menarik elektron luaran (tertutup atau valencia) lebih banyak daya).
Lapisan Valencia 4S tidak hilang: hanya kosong untuk ion -ion ini.
Contoh lapisan Valencia
Konsep lapisan Valencia boleh secara langsung atau tidak langsung dalam banyak aspek kimia.
Kerana elektron mereka adalah mereka yang mengambil bahagian dalam pembentukan bon, apa -apa topik yang menangani mereka (TEV, RPECV, mekanisme tindak balas, dll.) Anda mesti merujuk lapisan tersebut.
Ini kerana, lebih penting daripada lapisan valensi, mereka adalah elektronnya, yang dipanggil elektron Valencia. Apabila mewakili pembinaan progresif konfigurasi elektronik, mereka menentukan struktur elektronik atom, dan, oleh itu, sifat kimianya.
Dari maklumat ini dari One Atom A dan yang lain B, struktur sebatian mereka dapat dipihak melalui struktur Lewis. Begitu juga, struktur elektronik dan molekul pelbagai sebatian dapat ditentukan terima kasih kepada bilangan elektron valensi.
Contoh -contoh lapisan valensi yang mungkin dan paling mudah adalah dalam jadual berkala; Khususnya, dalam konfigurasi elektronik.
Contoh 1
Adalah mungkin untuk mengenal pasti elemen dan lokasinya dalam jadual berkala hanya dengan konfigurasi elektronik. Oleh itu, jika elemen x mempunyai konfigurasi [kr] 5s25 p1, Apa itu dan tempoh dan kumpulan berapa?
Diberi n= 5, x berada dalam tempoh kelima. Di samping itu, ia mempunyai tiga elektron Valencia: dua dalam orbit 5s2 Dan satu di 5p1. Lapisan dalaman [kr] tidak memberikan lebih banyak maklumat.
Ia boleh melayani anda: Asid Bromhydric (HBR)Oleh kerana X mempunyai tiga elektron, dan orbital 5pnya tidak lengkap, ia berada di blok P; Selain itu, dalam kumpulan IIIa (Romanesque) atau 13 (sistem penomboran semasa oleh IUPAC). X kemudiannya elemen India, dalam.
Contoh 2
Apakah elemen x dengan konfigurasi elektronik [kr] 4D105s1? Perhatikan bahawa seperti dalam, ia tergolong dalam tempoh 5, kerana orbital 5s1 adalah tenaga yang paling banyak. Walau bagaimanapun, lapisan Valencia juga termasuk orbital 4D, kerana mereka tidak lengkap.
Lapisan Valencia kemudiannya boleh ditetapkan sebagai NSNP, untuk elemen blok P atau S; atau (n-1) DNS, untuk elemen blok d. Supaya elemen misteri X milik Blok D kerana konfigurasi elektroniknya adalah jenis (n-1) DNS (4D105s1).
Kumpulan mana yang dimiliki? Menambah sepuluh elektron orbital 4d10, dan satu daripada 5s1, X mempunyai sebelas elektron dari Valencia. Oleh itu, ia mesti terletak di kumpulan ib u 11. Kemudian perjalanan melalui tempoh 5 jadual berkala sehingga kumpulan 11 anda mencapai elemen perak, AG.
Rujukan
- Shiver & Atkins. (2008). Kimia Inorganik (Edisi Keempat, ms. 23). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. Kimia (ed ke -8.). Pembelajaran Cengage, p. 287.
- Pusat Sumber NDT (s.F.). Shell valence. Diambil dari: nde-ed.org
- Kolej Komuniti Clackamas (2002). Elektron valensi. Diperolehi dari: DL.Clackamas.Edu
- Kimia Librettexts (s.F.). Elektron valensi dan teras. Pulih dari: chem.Libretxts.org

