Ammonium karbonat ((NH4) 2CO3)
- 1672
- 351
- Erick Krajcik
Apa itu ammonium karbonat?
Dia Ammonium karbonat Ia adalah garam nitrogen bukan organik, khususnya ammoniacal, yang formulanya adalah (NH4)2Co3. Ia dihuraikan dengan kaedah sintesis, di antaranya bernilai menggunakan sublimasi campuran ammonium sulfat dan kalsium karbonat: (NH4)2SW4(s)+ Caco3(s) => (NH4)2Co3(s)+ kes4(S).
Umumnya, garam ammonium dan kalsium karbonat dipanaskan dalam bekas untuk menyebabkan ammonium karbonat. Kaedah perindustrian yang menghasilkan banyak garam ini adalah untuk lulus karbon dioksida melalui lajur penyerapan yang mengandungi larutan ammonium dalam air, kemudian melakukan penyulingan.
Wap yang mengandungi ammonium, karbon dioksida dan air dipendekkan untuk membentuk kristal ammonium karbonat: 2nh3(g)+ h2Atau (l) + co2(g) → (NH4)2Co3(S). Dalam tindak balas asid karbonik berlaku, h2Co3, Setelah membubarkan karbon dioksida di dalam air, dan asid ini menghasilkan dua protonnya, h+, hingga dua molekul ammonia.
Sifat ammonium karbonat
 Penampilan ammonium karbonat
Penampilan ammonium karbonat Ia adalah pepejal putih, kristal dan tidak berwarna, dengan bau yang kuat dan rasa ammonia. Cair hingga 58 °.
Walau bagaimanapun, penguraian ini berlaku dalam dua langkah: pertama molekul NH dikeluarkan3, menghasilkan bikarbonat ammonium (NH4HCO3); Dan kedua, jika pemanasan berterusan, karbonat adalah tidak seimbang.
Ia larut dalam air dan kurang larut dalam alkohol. Bentuk jambatan hidrogen dengan air, dan apabila 5 gram dibubarkan dalam 100 gram air, ia menghasilkan penyelesaian asas dengan pH sekitar 8.6.
Boleh melayani anda: Pengemulsi: proses emulsi, aspek molekul, aplikasiHubungan yang tinggi untuk air dibuat oleh pepejal hygroscopic (ia menyerap kelembapan), dan itulah sebabnya sukar untuk mencarinya dalam bentuk anhidridnya. Malah, bentuk monohidratnya, (NH4)2Co3· H2O), adalah yang paling biasa dari semua dan menerangkan bagaimana garam adalah pembawa gas ammonia, menyebabkan bau.
Di udara ia pecah untuk menjana ammonium bikarbonat dan ammonium karbonat (NH4NH2Co2).
Struktur kimia
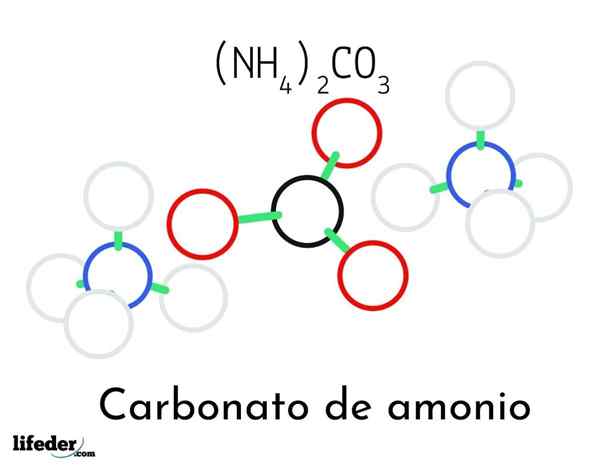
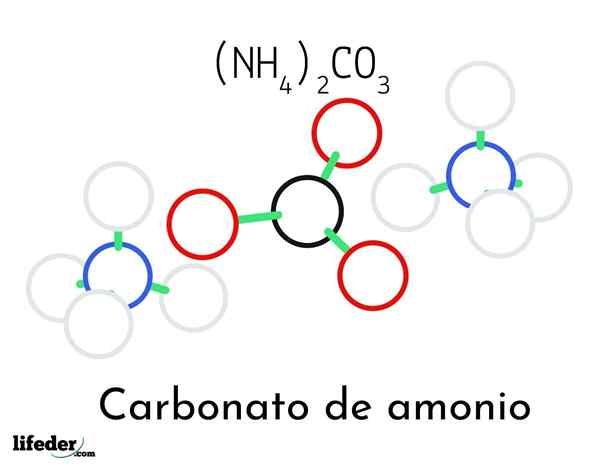
 Model struktur karbonat ammonium; Dua ammonium dan satu kation karbonat
Model struktur karbonat ammonium; Dua ammonium dan satu kation karbonat Dalam imej unggul struktur kimia ammonium karbonat digambarkan. Di tengah adalah anion co32-, segitiga rata dengan pusat hitam dan sfera merah; Dan ke dua pihaknya, kation ammonios4+ dengan geometri tetrahedral.
Geometri ion ammonium dijelaskan oleh hibridisasi SP3 atom nitrogen, memerintahkan atom hidrogen (sfera putih) di sekelilingnya dalam bentuk tetrahedron. Antara tiga ion yang ditubuhkan oleh jambatan hidrogen (h3N-H- O-CO22-).
Terima kasih kepada geometrinya, satu co -anion32- boleh membentuk sehingga tiga jambatan hidrogen; manakala kation NH4+ Mungkin mereka tidak dapat membentuk empat jambatan hidrogen yang sepadan kerana penolakan elektrostatik di antara caj positif mereka.
Hasil dari semua interaksi ini adalah penghabluran sistem ortorrombik. Mengapa begitu hygroscopic dan larut air? Jawapannya adalah dalam perenggan sebelumnya: Jambatan Hidrogen.
Interaksi ini bertanggungjawab untuk penyerapan air cepat garam anhidrid untuk membentuk (NH4)2Co3· H2Sama ada). Ini mengakibatkan perubahan dalam susunan ruang ion, dan oleh itu, dalam struktur kristal.
Ia boleh melayani anda: nikel klorida (NICL2): struktur, sifat, mendapatkan, menggunakanCuriosities struktur
Tidak kira betapa mudahnya (NH kelihatan seperti4)2Co3, Sangat sensitif terhadap transformasi yang tidak terhitung jumlahnya bahawa strukturnya adalah misteri yang dikemukakan kepada komposisi sebenar pepejal. Struktur ini juga berbeza mengikut tekanan yang mempengaruhi kristal.
Beberapa penulis telah mendapati bahawa ion diperintahkan sebagai coplanares yang dipenuhi oleh jambatan hidrogen (iaitu, rantai dengan urutan NH4+-Co32--...) di mana molekul air mungkin berfungsi sebagai penyambung ke rantai lain.
Lebih -lebih lagi, melampaui langit terestrial, bagaimana kristal -kristal ini dalam keadaan spatial atau interstellar? Apakah komposisi anda dari segi kestabilan spesies berkarbonat? Terdapat kajian yang mengesahkan kestabilan hebat kristal -kristal yang terperangkap di planet dan komet jisim.
Ini membolehkan mereka berfungsi sebagai rizab karbon, nitrogen dan hidrogen, yang menerima sinaran suria, boleh diubah menjadi bahan organik seperti asid amino.
Iaitu, blok ammoniacal ais krim ini boleh menjadi pembawa "roda yang memulakan jentera kehidupan". Atas sebab -sebab ini, minat mereka dalam bidang astrobiologi dan biokimia semakin meningkat.
Penggunaan/aplikasi
Ia digunakan sebagai leuers, kerana dipanaskan menghasilkan karbon dioksida dan gas ammonium. Ammonium karbonat adalah, jika anda mahu, pendahulu untuk serbuk penaik moden dan boleh digunakan untuk membakar kuki dan biskut rata.
Walau bagaimanapun, penggunaannya untuk membakar kek tidak disyorkan. Kerana ketebalan kek, gas ammonium dikekalkan di dalam dan menghasilkan rasa yang tidak menyenangkan.
Ia boleh melayani anda: Cyclohexen: struktur, sifat, sintesis dan kegunaanIa digunakan sebagai expectorant, iaitu, melegakan batuk ketika menghancurkan bronkus. Ia mempunyai tindakan fungisida, menggunakan sebab ini dalam bidang pertanian. Ia juga merupakan pengawal selia keasidan yang ada dalam makanan dan digunakan dalam sintesis urea organik dalam tekanan tinggi, dan hidantoinas.
Risiko
Ammonium karbonat sangat beracun. Ia menghasilkan manusia kerengsaan akut rongga mulut ketika menyentuh.
Di samping itu, jika ditelan menyebabkan kerengsaan gastrik. Tindakan serupa diperhatikan di mata yang terdedah kepada ammonium karbonat.
Penyedutan gas penguraian garam, boleh merengsakan hidung, tekak dan paru -paru, menyebabkan batuk dan tekanan pernafasan.
Pendedahan anjing akut pada ammonat ammonat pada dos 40 mg/kg berat, menyebabkan muntah dan cirit -birit. Dos tertinggi ammonium karbonat (200 mg/kg berat) biasanya mematikan. Kerosakan jantung ditunjukkan sebagai punca kematian.
Sekiranya ia dipanaskan pada suhu yang sangat tinggi dan di udara diperkaya dengan oksigen, ia mengeluarkan gas toksik2.
Rujukan
- Pubchem. (2018). Ammonium karbonat. Diperoleh pada 25 Mac, 2018, dari Pubchem: Pubchem.NCBI.NLM.NIH.Gov
- Portal Kimia Organik. ((2009-2018)). Reaksi Bucherer-Bergs. Diperoleh pada 25 Mac, 2018, dari Portal Kimia Organik: www.Kimia organik.org
- Wikipedia. (2018). Ammonium karbonat. Diperoleh pada 25 Mac, 2018, dari Wikipedia: IN.Wikipedia.org
- Syarikat Kimia. (2018). Syarikat Kimia. Diperoleh pada 25 Mac, 2018, dari Syarikat Kimia: Thechemco.com