Struktur, Kapassium Karbonat (K2CO3) Struktur, Harta, Kegunaan, Mendapatkan

- 3551
- 465
- Dallas Bernhard
Dia Potassium karbonat Ia adalah sebatian bukan organik yang dibentuk oleh dua ion kalium k+ dan Co Coal Co32-. Formula kimianya adalah k2Co3. Ia adalah pepejal putih hygroscopic, iaitu, dengan mudah menyerap air dari alam sekitar. Oleh itu di makmal ia digunakan untuk menyerap air dari bahan lain.
Ia sangat larut dalam penyelesaian alkali yang membentuk air, yang kaya dengan ion oh-dan oleh itu dengan nilai pH yang tinggi. Penyelesaian berairnya, kerana ia adalah alkali, digunakan dalam beberapa proses perindustrian untuk menyerap gas asid seperti karbon dioksida2 dan hidrogen sulfida h2S, kemudian dengan mudah meneutralkannya.
 Potassium karbonat k2Co3 pepejal. Ondřej Mangl [domain awam]. Sumber: Wikimedia Commons.
Potassium karbonat k2Co3 pepejal. Ondřej Mangl [domain awam]. Sumber: Wikimedia Commons. K2Co3 Ia digunakan untuk menyediakan sabun, produk pembersihan, detergen untuk mencuci pakaian dan campuran untuk mencuci pinggan. Ia juga digunakan dalam pemprosesan beberapa gentian tekstil seperti bulu.
Ia digunakan secara meluas dalam makmal kimia, contohnya untuk menyerap air dari sebatian lain atau untuk mengikat campuran reaksi kimia dan juga dalam analisis kimia.
Contohnya, ia juga ditambah kepada beberapa makanan, sebagai contoh, untuk menghapuskan rasa pahit biji koko semasa pengeluaran coklat.
[TOC]
Struktur
Karbonat Potassium terdiri daripada dua kalium k kation+ dan co anion karbonat32-. Anion karbonat mempunyai struktur rata dan simetri, manakala tiga atom oksigen mengelilingi karbon membentuk segitiga rata.
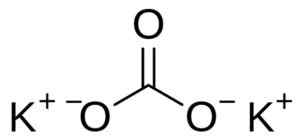 Struktur Karbonat Potassium K2Co3. Pengguna: edgar181 [domain awam]. Sumber: Wikimedia Commons.
Struktur Karbonat Potassium K2Co3. Pengguna: edgar181 [domain awam]. Sumber: Wikimedia Commons. Nomenclature
- Potassium karbonat
- Potassium karbonat
- Dipotasium karbonat
- Potash
- Garam kalium asid karbonik.
Sifat
Keadaan fizikal
Kristal pepejal berwarna putih.
Berat molekul
138,205 g/mol.
Takat lebur
899 ºC.
Takat didih
Ia terurai.
Ketumpatan
2.29 g/cm3
Kelarutan
Sangat larut dalam air: 111 g/100 g air pada suhu 25 ° C. Tidak larut dalam etanol dan aseton.
Boleh melayani anda: Sumbangan dari Kimia ke PerubatanPh
Penyelesaian berair boleh mempunyai pH 11.6, iaitu, ia agak alkali.
Sifat kimia
Potassium karbonat adalah enak atau hygroscopic, iaitu, ia menyerap kelembapan alam sekitar. Ia mempunyai hidrat yang stabil, k2Co3.2h2Sama ada.
K2Co3 Dalam larutan berair ia dihidrolisiskan, iaitu, ia bertindak balas dengan air dengan melepaskan kumpulan OH- Yang memberi kealkalian kepada penyelesaian:
Co32- + H2Atau ⇔ Oh- + HCO3-
HCO3- + H2Atau ⇔ Oh- + H2Co3
Memperoleh
Dapat diperoleh dari abu yang tinggal ketika membakar tumbuh -tumbuhan. Juga dengan pengkarbonan KOH kalium hidroksida, iaitu, menambah lebihan karbon dioksida Co2 Ke koh:
KOH + CO2 → KHCO3
2 khco3 + Haba → k2Co3 + H2Sama ada
Cara lain untuk mendapatkannya ialah memanaskan KCl Potassium Chloride dengan magnesium karbonat3, air dan co2 dibawah tekanan. Garam dan kalium dan kalium kalium dan kalium yang terhidrat diperoleh terlebih dahulu3.KHCO3.4H2Atau, dipanggil garam Engels:
2 kcl + 3 mgco3 + Co2 + 5 jam2O → mgco3.KHCO3.4H2Atau ↓ + mgCl2
Garam terhidrat ganda Engels mendahului dan memisahkan dari penyelesaian dengan penapisan. Kemudian karbonat kereta kalium dipanaskan dan terbentuk2Co3 dengan menambah air larut sementara mgco magnesium karbonat3 tetap tidak larut dan dihapuskan oleh penapisan.
Mgco3.KHCO3.4H2O + panas → mgco3↓ + 2 k+ + Co32- + Co2↑ + 9 jam2Sama ada
Aplikasi
Dalam penyerapan CO2 Dalam proses perindustrian
Penyelesaian Potassium Karbonat adalah rawatan klasik untuk penyingkiran karbon dioksida2 Dalam pelbagai proses, terutamanya dalam tekanan tinggi dan aplikasi suhu.
 Penyelesaian k2Co3 Mereka digunakan untuk menyerap co2 Dalam pelbagai proses perindustrian. Pengarang: Nicola Giordano. Sumber: Pixabay.
Penyelesaian k2Co3 Mereka digunakan untuk menyerap co2 Dalam pelbagai proses perindustrian. Pengarang: Nicola Giordano. Sumber: Pixabay. Penyingkiran co2 berlaku mengikut reaksi berikut:
K2Co3 + Co2 + H2Atau ⇔ 2 khco3
Kaedah ini digunakan sebagai contoh untuk merawat gas asli. Juga dalam loji penjanaan tenaga, untuk mengelakkan pelepasan CO2 ke atmosfera, dan dalam pengeluaran ais kering.
Boleh melayani anda: Tembaga hidroksida (ii): Struktur, sifat, tatanama, kegunaan Penyelesaian k2Co3 Mereka digunakan untuk mendapatkan Co2 yang berfungsi untuk menjadikan ais kering. ProjectManhattan [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Penyelesaian k2Co3 Mereka digunakan untuk mendapatkan Co2 yang berfungsi untuk menjadikan ais kering. ProjectManhattan [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. K -solution2Co3 Ia boleh menjadi tumbuh semula secara termal, iaitu, disebabkan oleh suhu panas sehingga 100 ° C.
Agar penyelesaian kalium karbonat untuk menyerap CO2 dengan kelajuan yang baik, para promoter ditambah yang mempercepat proses seperti dietanolamine (DEA).
Dalam penyingkiran H2S dari proses tertentu
Penyelesaian Potassium Karbonat juga digunakan untuk mengeluarkan gas sulfida hidrogen h2S arus proses. Kadang -kadang kalium tiffosphate k ditambah3PO4 untuk membuat proses lebih cepat.
Di makmal kimia
K2Co3 Membolehkan sintesis organik, sebagai contoh, dalam tindak balas pemeluwapan dan meneutralkan. Ia berfungsi untuk mengeluarkan air dari cecair organik, sebagai ejen dehidrasi atau pengering di makmal.
Ia juga digunakan dalam tindak balas kimia analisis dan untuk alkali dalam industri farmaseutikal.
Dalam industri produk pembersihan
K2Co3 Ia digunakan untuk mengeluarkan sabun, formula pembersihan, produk untuk pakaian dan pencucian hidangan dan juga untuk menyediakan syampu dan produk penjagaan peribadi lain.
 K2Co3 Ia digunakan dalam penyediaan sabun. Lacrosus [domain awam]. Sumber: Wikimedia Commons.
K2Co3 Ia digunakan dalam penyediaan sabun. Lacrosus [domain awam]. Sumber: Wikimedia Commons. Dalam industri makanan
Karbonat Potassium ditambah kepada pelbagai makanan dengan beberapa tujuan.
Sebagai contoh, ia ditambah kepada biji koko untuk menghapuskan rasa pahit mereka dan menggunakannya dalam pengeluaran coklat. Ia ditambah kepada anggur dalam proses pengeringan untuk mendapatkan anggur kismis.
 Biji koko dirawat dengan k2Co3 Untuk mengurangkan rasa pahit ketika membuat coklat. Pengarang: Magali Couret. Sumber: Pixabay.
Biji koko dirawat dengan k2Co3 Untuk mengurangkan rasa pahit ketika membuat coklat. Pengarang: Magali Couret. Sumber: Pixabay. Di kedai pastri ia digunakan sebagai beaudant (bertindak sebagai ragi) tepung untuk menyediakan makanan bakar.
Boleh melayani anda: Lutecio: struktur, sifat, kegunaan, memperoleh K2Co3 Ia boleh digunakan sebagai pemimpin dalam kek kerana apabila ia mengeluarkan co2 Semasa memasak jumlah peningkatan ini. Pengarang: Pixel1. Sumber: Pixabay.com
K2Co3 Ia boleh digunakan sebagai pemimpin dalam kek kerana apabila ia mengeluarkan co2 Semasa memasak jumlah peningkatan ini. Pengarang: Pixel1. Sumber: Pixabay.com Dalam baja
K2Co3 Ia digunakan untuk menyuburkan tanah asid, kerana Co Coal Co32- Bersentuhan dengan air menghasilkan oh ion- yang meningkatkan pH tanah. Sebagai tambahan kepada kalium k+ Ia adalah nutrien untuk tumbuh -tumbuhan.
Potassium Carbonate juga telah digunakan untuk membuat baja yang perlahan.
Siaran baja yang perlahan -lambat atau nutrien longgar sehingga mereka tidak dibubarkan dan diseret oleh air. Terima kasih kerana ini, mereka boleh menghabiskan lebih banyak masa untuk akar tumbuhan.
Dalam beberapa aplikasi
Potassium karbonat k2Co3 Ia juga digunakan untuk:
- Proses pembersihan bulu pengeringan, peluntur dan bersih dan aktiviti industri tekstil lain
- Mendapatkan garam kalium organik dan bukan organik lain, seperti KCN Potassium Cyanide.
- Berfungsi sebagai pengawal selia keasidan dalam pelbagai proses.
- Buat seramik dan tembikar.
- Proses ukiran dan litografi.
- Tan.
- Sediakan dakwat cetak, pigmen.
- Kaca manufacce2Co3 Ia lebih serasi daripada natrium karbonat na2Co3 Dengan plumbum, barium dan strontium oksida yang mengandungi kaca ini.
- Rawatan air.
- Kelewatan Kebakaran (dalam bentuk penyelesaian berair).
- Menghalang kakisan dan sebagai ejen anti-penari dalam pasukan proses.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Potassium karbonat. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Steele, d. (1966). Kimia Elemen Metalik. Pergamon Press Ltd. London.
- Mokhatab, s. et al. (2019). Gas asli merawat. Penyelesaian kalium karbonat. Dalam Buku Panduan Penghantaran dan Pemprosesan Gas Asli (Edisi Keempat). Pulih dari Scientedirect.com.
- Kakaras, e. et al. (2012). Sistem Kitaran Pembakaran Bed (PFBC) bertekanan bertekanan (PFBC). Pembakaran katil bertekanan bertekanan dengan penangkapan dan penyimpanan karbon. Dalam sistem kitaran gabungan untuk penjanaan kuasa pelepasan berhampiran sifar. Pulih dari Scientedirect.com.
- Speight, j.G. (2019). Pengeluaran hidrogen. Scrubbing basah. Dalam pemulihan minyak berat dan menaik taraf. Pulih dari Scientedirect.com.
- Branan, c.R. (2005). Rawatan Gas: Bab Dikemaskini oleh Chris Higman. Proses karbonat panas. Dalam Peraturan Thumb untuk Jurutera Kimia (Edisi Keempat). Pulih dari Scientedirect.com.
- Kirk-Othmer (1994). Ensiklopedia Teknologi Kimia. Edisi keempat. John Wiley & Sons.
- Ensiklopedia Kimia Perindustrian Ullmann. (1990). Edisi Kelima. VCH Verlagsgellschaft MBH.
- Li, dan. dan Cheng, F. (2016). Sintesis baja kalium perlahan-lambat novel dari Slag Magnesium Pidgeon yang diubahsuai oleh Potassium Carbonate. J Air Waste Manag Assoc, 2016 Aug; 66 (8): 758-67. NCBI pulih.NLM.NIH.Gov.

