Struktur kalsium karbida (CAC2), sifat, mendapatkan, menggunakan

- 2423
- 622
- Horace Gulgowski
Dia Kalsium karbida Ia adalah sebatian bukan organik yang dibentuk oleh elemen kalsium (Ca) dan karbon (c) (c). Formula kimianya adalah CAC2. Ia adalah pepejal yang boleh berwarna putih kekuningan atau kelabu, dan bahkan hitam bergantung pada kekotoran yang terkandung di dalamnya.
Salah satu reaksi kimia yang paling penting dari CAC2 adalah yang berlaku dengan air h2Atau, di mana bentuk asetilena HC≡CH. Oleh itu ia digunakan untuk mendapatkan asetilena secara industri. Kerana tindak balas air yang sama digunakan untuk buah -buahan matang, di meriam palsu dan suar tentera laut.
 CAC Calcium Carbide2 pepejal. Domain Ondřej Mangl / Pub. Sumber: Wikimedia Commons.
CAC Calcium Carbide2 pepejal. Domain Ondřej Mangl / Pub. Sumber: Wikimedia Commons. Reaksi CAC2 Dengan air juga menghasilkan lumpur yang berguna untuk menyediakan klinker (komponen simen), yang menghasilkan kurang karbon dioksida (CO2) Jika dibandingkan dengan kaedah tradisional menghasilkan simen.
Dengan nitrogen (n2) Kalsium karbida bentuk sianamida kalsium, yang digunakan sebagai baja. CAC2 Ia juga digunakan untuk mengeluarkan sulfur dari aloi logam tertentu.
Beberapa waktu yang lalu CAC2 Ia digunakan dalam lampu karbida yang dipanggil, tetapi ini tidak lagi biasa kerana mereka berbahaya.
[TOC]
Struktur
Kalsium karbida adalah sebatian ionik dan dibentuk oleh ion CA calcio2+ dan karbida atau acetyluro c22-. Ion karbida terdiri daripada dua atom karbon bersatu dengan ikatan tiga.
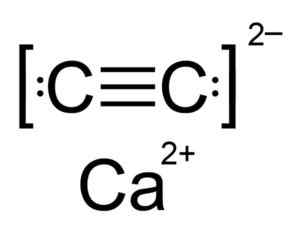 Struktur Kimia Kalsium Karbida. Pengarang: Hellbus. Sumber: Wikimedia Commons.
Struktur Kimia Kalsium Karbida. Pengarang: Hellbus. Sumber: Wikimedia Commons. Struktur kristal CAC2 Ia berasal dari kubik (seperti natrium klorida NaCl), tetapi seperti ion c22- Strukturnya dipanjangkan diputarbelitkan dan bertukar tetragonal.
Nomenclature
- Kalsium karbida
- Kalsium karbida
- Kalsium asetilur
Sifat
Keadaan fizikal
Pepejal kristal bahawa apabila tulen tidak berwarna, tetapi jika ia tercemar dengan sebatian lain, ia boleh menjadi kekuningan atau kelabu hingga hitam.
 CAC Calcium Carbide2 Dengan kekotoran. Leiem/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons.
CAC Calcium Carbide2 Dengan kekotoran. Leiem/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons. Berat molekul
64,0992 g/mol
Ia boleh melayani anda: Alilo: Unit Allyic, Carbocation, Radikal, ContohTakat lebur
2160 ºC
Takat didih
CAC2 mendidih pada 2300 ºC dengan penguraian. Titik mendidih harus diukur di bawah atmosfera lengai, iaitu, tanpa oksigen atau kelembapan.
Ketumpatan
2.22 g/cm3
Sifat kimia
Kalsium karbida bertindak balas dengan air untuk membentuk HC≡CH acetylene dan CA kalsium hidroksida (OH)2:
CAC2 + 2 jam2O → HC≡CH + CA (OH)2
Acetylene mudah terbakar, oleh itu dengan kehadiran kelembapan CAC2 Ia boleh mudah terbakar. Namun, apabila kering itu tidak.
 CAC Calcium Carbide2 Dengan bentuk hc≡CH acetylene bentuk, kompaun mudah terbakar. Kristina Kravets/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons.
CAC Calcium Carbide2 Dengan bentuk hc≡CH acetylene bentuk, kompaun mudah terbakar. Kristina Kravets/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons. Kalsium karbida bertindak balas dengan nitrogen n2 Untuk membentuk CACN Calcio Cyanamide2:
CAC2 + N2 → CACN2 + C
Memperoleh
Kalsium karbida dihasilkan secara industri dalam ketuhar arka elektrik berdasarkan campuran kalsium karbonat (Caco3) dan arang batu (c) yang dikemukakan pada suhu 2000 ° C. Reaksi diringkaskan seperti berikut:
Pencuri3 + 3 C → CAC2 + CO ↑ + Co2↑
Atau juga:
Cao + 3 c → cac2 + CO ↑
Dalam ketuhar arka elektrik terdapat arka elektrik antara dua elektrod grafit, yang menentang suhu tinggi yang terbentuk. Kalsium karbida dengan kesucian 80-85% diperolehi.
Aplikasi
Dalam pengeluaran asetilena
Secara industri, reaksi kalsium karbida dengan air untuk menghasilkan asetilena c digunakan2H2.
CAC2 + 2 jam2O → HC≡CH + CA (OH)2
Ini adalah penggunaan karbida kalsium yang paling penting. Di sesetengah negara, asetilena sangat dihargai, kerana ia membolehkan menghasilkan polyvinyl chloride, yang merupakan sejenis plastik. Di samping itu asetilena berfungsi untuk melaksanakan kimpalan pada suhu tinggi.
 Logam nyalaan asetilena HC≡CH pada suhu yang sangat tinggi. Pengarang: ShutterBug75. Sumber: Pixabay.
Logam nyalaan asetilena HC≡CH pada suhu yang sangat tinggi. Pengarang: ShutterBug75. Sumber: Pixabay. Dalam mengurangkan pelepasan Co2
Sisa -sisa yang diperoleh daripada mendapatkan asetilena bermula dari CAC2 (Juga dipanggil "enapcemar kalsium karbida" atau "sisa kalsium karbida") yang digunakan untuk digunakan untuk mendapatkan klinker atau konkrit.
Boleh melayani anda: Aplikasi teknologi pelepasan atom elektronikLumpur Kalsium Karbida mempunyai kandungan kalsium hidroksida yang tinggi (CA (OH)2) (kira -kira 90%), beberapa kalsium karbonat (Caco3) dan mempunyai pH lebih besar daripada 12.
 Sisa kalsium karbida boleh digunakan dalam aktiviti pembinaan untuk menyediakan konkrit, dengan itu mengurangkan penjanaan CO2 industri tersebut. Pengarang: Engin Akyurt. Sumber: Pixabay.
Sisa kalsium karbida boleh digunakan dalam aktiviti pembinaan untuk menyediakan konkrit, dengan itu mengurangkan penjanaan CO2 industri tersebut. Pengarang: Engin Akyurt. Sumber: Pixabay. Atas sebab -sebab ini, anda boleh bertindak balas dengan SIO2 atau al2Sama ada3 membentuk produk yang serupa dengan yang diperolehi oleh proses penghidratan simen.
Salah satu aktiviti manusia yang menghasilkan yang paling banyak2 Ia adalah industri pembinaan. Co2 Ia dihasilkan di timur kalsium karbonat semasa reaksi untuk membentuk konkrit.
Menggunakan lumpur kalsium karbida untuk menggantikan kalsium karbonat (Caco3) Didapati bahawa co -emisi dikurangkan2 Dalam 39%.
Dalam mendapatkan kalsium sianamida
Kalsium karbida juga digunakan secara industri untuk mendapatkan CACN CYANMIDE CYANAMIDE2.
CAC2 + N2 → CACN2 + C
Kalsium cyanamide telah digunakan sebagai baja, kerana dengan air tanah ia menjadi cyanamide h2n = c = n, yang menyediakan nitrogen kepada tumbuhan, nutrien penting untuk ini.
Dalam industri metalurgi
Kalsium karbida digunakan untuk mengeluarkan aloi seperti Ferroníquel. CAC bercampur2 Dengan aloi cair pada 1550 ° C. Sulfur (s) bertindak balas dengan kalsium karbida dan kalsium sulfida CAS dan arang batu C:
CAC2 + S → 2 c + cas
Penyingkiran sulfur disukai jika pencampuran adalah cekap dan kandungan karbon dalam aloi rendah. Casclium kalsium sulfida terapung di permukaan aloi cair di mana ia memilih dan dibuang.
Dalam beberapa kegunaan
Kalsium karbida telah digunakan dalam penghapusan sulfur besi. Juga sebagai bahan bakar dalam pengeluaran keluli dan sebagai deoksida yang kuat.
Boleh melayani anda: penggantian elektrofilik aromatik: mekanisme dan contohIa digunakan untuk masak buah -buahan. Dari kalsium karbida dengan air, asetilena dihasilkan, yang mendorong kematangan buah -buahan, seperti pisang.
 Pisang boleh matang menggunakan karbida kalsium CAC2. Pengarang: Foto Alexas. Sumber: Pixabay.
Pisang boleh matang menggunakan karbida kalsium CAC2. Pengarang: Foto Alexas. Sumber: Pixabay. Kalsium karbida digunakan dalam meriam palsu untuk menyebabkan bunyi letupan kuat yang mencirikan mereka. Di sini juga digunakan pembentukan asetilena, yang meletup dengan percikan dalam artifak.
CAC2 Ia digunakan untuk menjana isyarat di lautan yang tinggi di suar tentera laut yang sendiri -konsisten.
Penggunaan yang dihentikan
CAC2 Ia telah digunakan dalam lampu karbida. Operasi ini terdiri daripada menetes air pada kalsium karbida untuk membentuk asetilena, yang menghidupkan dan dengan itu memberikan cahaya.
Lampu ini digunakan dalam lombong arang batu, tetapi penggunaannya dihentikan kerana kehadiran metana gas cho4 Di lombong ini. Gas ini mudah terbakar dan nyalaan lampu karbida dapat membuatnya api atau mengeksploitasi.
 Lampu karbida kalsium CAC2. Domain scehardt / pub. Sumber: Wikimedia Commons.
Lampu karbida kalsium CAC2. Domain scehardt / pub. Sumber: Wikimedia Commons. Mereka digunakan secara meluas di lombong batu slate, tembaga dan timah, dan juga di kereta pertama, motosikal dan basikal, seperti lampu depan atau lampu depan.
Mereka kini telah digantikan oleh lampu elektrik atau lampu LED. Walau bagaimanapun, mereka masih digunakan di negara -negara seperti Bolivia, di lombong perak Potosí.
Risiko
CAC Calcium Carbide2 kering tidak mudah terbakar tetapi dengan kehadiran kelembapan bentuk asetilena, iaitu.
Untuk memadamkan api di hadapan CAC2 Air, busa, karbon dioksida atau pemadam halogen tidak boleh digunakan. Natrium atau kalsium hidroksida harus digunakan.
Rujukan
- Ropp, r.C. (2013). Kumpulan 14 (C, SI, GE, SN, dan PB) sebatian bumi alkali. Kalsium karbida. Dalam ensiklopedia sebatian bumi alkali. Pulih dari Scientedirect.com.
- Pohanish, r. P. (2017). C. Kalsium karbida. Dalam Buku Panduan Bahan Kimia dan Karsinagen Beracun Sittig (Edisi Ketujuh). Pulih dari Scientedirect.com.
- Matahari, h. et al. (2015). Sifat -sifat Kalsium Kalsium Karbida yang Digabungkan Kimia Dan Tidak Betul Pada Sifat Simen. Bahan 2015, 8, 638-651. NCBI pulih.NLM.NIH.Gov.
- Nie, Z. (2016). Material dan penilaian kitaran hayat. Kajian Kes: Co2 Analisis pelepasan klinker enapcemar kalsium karbida. Dalam pembuatan bahan maju hijau dan lestari. Pulih dari Scientedirect.com.
- Crundwell, f.K. Et al. (2011). Memperbaiki ferronickel cair. Penyingkiran sulfur. Dalam logam metalurgi nikel, kobalt dan platinum kumpulan. Pulih dari Scientedirect.com.
- Tressler, r.Dan. (2001). Seramik struktur dan thermmostructural. Karbida. Dalam Ensiklopedia Sains dan Teknologi Bahan. Pulih dari Scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.

