Sel elektrokimia
- 4162
- 499
- Donnie Ryan
Apakah sel elektrokimia?
The sel elektrokimia Mereka adalah peranti di mana tindak balas kimia lulus di mana tenaga kimia diubah menjadi elektrik atau sebaliknya. Sel -sel ini membentuk jantung elektrokimia, jiwa menjadi pertukaran potensi elektron yang boleh berlaku, spontan atau tidak secara spontan, antara dua spesies kimia.
Salah satu daripada dua spesies mengoksidakan, kehilangan elektron, sementara yang lain dikurangkan dengan memenangi elektron yang diserahkan. Biasanya spesies yang dikurangkan adalah kation logam dalam larutan, yang dengan memperoleh elektrik berakhir secara elektrik pada elektrod yang diperbuat daripada logam yang sama. Sebaliknya, spesies yang mengoksidakan adalah logam, menjadi kation logam.
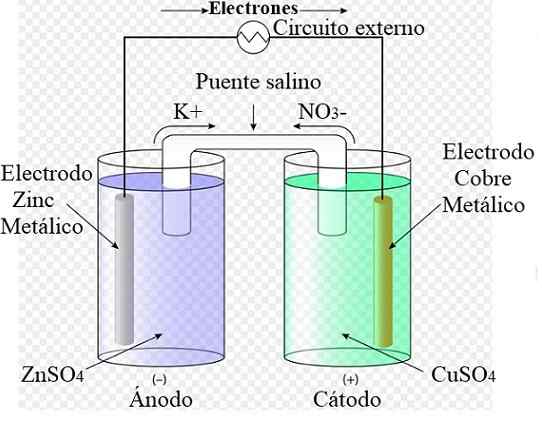
 Rajah sel elektrokimia Daniel. Sumber: Rechua [CC oleh (https: // creativeCommons.Org/lesen/oleh/3.0)]
Rajah sel elektrokimia Daniel. Sumber: Rechua [CC oleh (https: // creativeCommons.Org/lesen/oleh/3.0)] Sebagai contoh, imej unggul mewakili sel Daniel: yang paling mudah dari semua sel elektrokimia. Elektrod zink logam dioksidakan, melepaskan kation Zn2+ ke persekitaran berair. Ini berlaku di dalam bekas ZnSO4 dari kiri.
Di sebelah kanan, penyelesaian yang mengandungi CUO4 Ia dikurangkan, mengubah kation CU2+ Dalam tembaga logam yang didepositkan pada elektrod tembaga. Semasa perkembangan tindak balas ini, elektron mengembara litar luaran yang mengaktifkan mekanisme mereka; Dan oleh itu, menyediakan elektrik untuk operasi peralatan.
Komponen sel elektrokimia
Elektrod
Dalam sel elektrokimia dihasilkan atau dimakan. Untuk memastikan aliran elektron yang betul mesti ada bahan yang merupakan konduktor elektrik yang baik. Di sinilah elektrod dan litar luaran datang, disediakan dengan pendawaian tembaga, perak atau emas.
Elektrod adalah bahan yang menyediakan permukaan di mana tindak balas dalam sel elektrokimia akan dibangunkan. Terdapat dua jenis mengikut reaksi yang berlaku di dalamnya:
- Anod, elektrod di mana pengoksidaan berlaku.
- Katod, elektrod di mana pengurangan berlaku.
Elektrod boleh dibuat daripada bahan yang bertindak balas, seperti dalam kes sel Daniel (zink dan tembaga); atau, bahan lengai, seperti halnya ketika mereka diperbuat daripada platinum atau grafit.
Elektron yang diberikan oleh anod mesti mencapai katod; Tetapi tidak melalui penyelesaian, tetapi bergerak kabel logam yang bergabung dengan kedua -dua elektrod ke litar luaran.
Pembubaran elektrolit
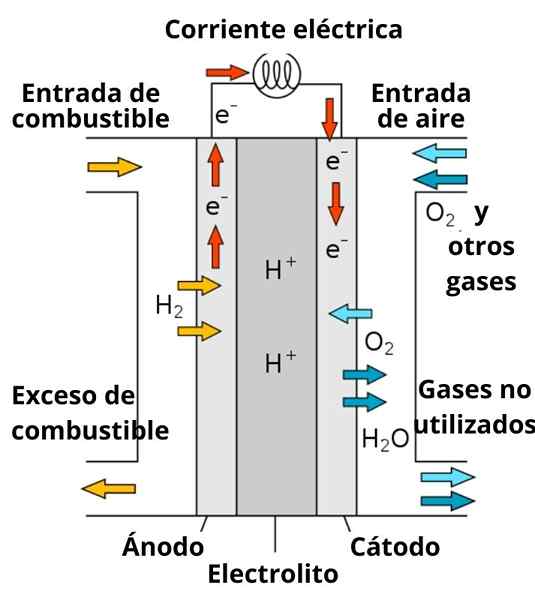 Skim bateri bahan api konduktif proton
Skim bateri bahan api konduktif proton Pembubaran yang mengelilingi elektrod juga memainkan peranan penting, kerana ia diperkaya dengan elektrolit yang kuat; seperti: kcl, kno3, NaCl, dll. Ion -ion ini memihak kepada tahap penghijrahan elektron dari anod ke katod, serta pengalirannya oleh sekitar elektrod untuk berinteraksi dengan spesies untuk mengurangkan.
Air laut, sebagai contoh, membawa elektrik yang lebih baik daripada air suling, dengan kepekatan ion yang lebih rendah. Itulah sebabnya sel elektrokimia mempunyai penyelesaian elektrolit yang kuat di kalangan komponen mereka.
Jambatan Saline
Ion penyelesaian mula mengelilingi elektrod yang menyebabkan polarisasi beban. Pembubaran di sekeliling katod mula mengenakan bayaran negatif, kerana kation dikurangkan; Dalam kes sel Daniel, Cu Cations2+ Dengan mendepositkan sebagai tembaga logam di katod. Oleh itu, terdapat defisit caj positif.
Di sinilah jambatan salin campur tangan untuk mengimbangi beban dan menghalang elektrod daripada dipolarisasi. Ke sisi atau petak kation katod jambatan salin akan berhijrah, sama ada k+ atau Zn2+, Untuk menggantikan CU2+ dimakan. Sementara itu, dari Jambatan Saline tidak akan memindahkan Anion3- Ke arah petak anod, untuk meneutralkan kepekatan zn yang semakin meningkat2+.
Ia boleh melayani anda: kalium dikromat: formula, sifat, risiko dan kegunaanJambatan Saline terdiri daripada larutan garam tepu, dengan hujungnya diliputi oleh gel ion yang telap, tetapi kalis air untuk air.
Jenis sel elektrokimia dan bagaimana ia berfungsi
Cara di mana sel elektrokimia berfungsi bergantung pada jenis yang. Terdapat dua jenis: galvanik (atau voltan) dan elektrolitik
Galvanics
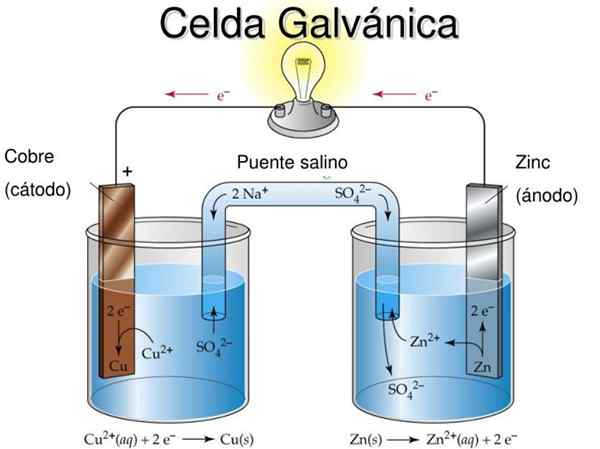
Sel Daniel adalah contoh sel elektrokimia galvanik. Di dalamnya tindak balas berlaku secara spontan dan potensi bateri adalah positif; Semakin besar potensi, semakin besar elektrik yang akan membekalkan sel.
Bateri atau bateri adalah sel -sel galvanik yang tepat: potensi kimia antara kedua -dua elektrod berubah menjadi tenaga elektrik apabila litar luaran campur tangan yang menghubungkan mereka. Oleh itu, elektron berhijrah dari anod, menyalakan peralatan yang disambungkan oleh bateri, dan dikembalikan terus ke katod.
Elektrolytic
Sel -sel elektrolitik adalah mereka yang tindak balasnya tidak berlaku secara spontan, kecuali jika ia dibekalkan oleh tenaga elektrik dari sumber luaran. Di sini fenomena yang bertentangan berlaku: elektrik membolehkan tindak balas kimia bukan -spontan untuk berkembang.
Salah satu tindak balas yang paling terkenal dan berharga yang berlaku dalam jenis sel ini adalah elektrolisis.
Bateri yang boleh dicas semula adalah contoh elektrolitik dan pada masa yang sama galvanik: mereka dicas semula untuk membalikkan reaksi kimia mereka dan membina semula keadaan awal untuk digunakan semula.
Contoh
Sel Daniel
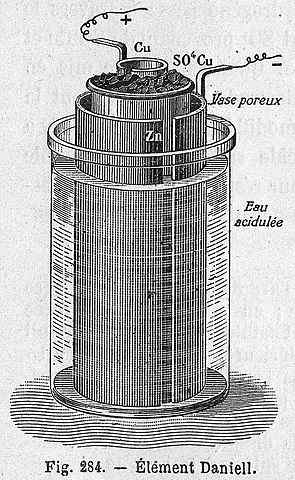 Skim sel Daniel
Skim sel Daniel Persamaan kimia berikut sepadan dengan reaksi sel Daniel di mana zink dan tembaga mengambil bahagian:
Boleh melayani anda: menyewa halogenuros: sifat, mendapatkan, contohZn (s) + cu2+(aq) → Zn2+(aq) + cu (s)
Tetapi Cu Cations2+ dan Zn2+ Mereka tidak bersendirian tetapi disertai dengan anion SO42-. Sel ini boleh diwakili seperti berikut:
Zn | Znso4 | | Cuso4 | Cu
Sel Daniel boleh dibina di mana -mana makmal, yang sangat berulang sebagai amalan dalam pengenalan elektrokimia. Sebagai cu2+ Ia disimpan sebagai CU, warna biru penyelesaian CUSO4 Ia akan hilang.
Sel platinum dan hidrogen
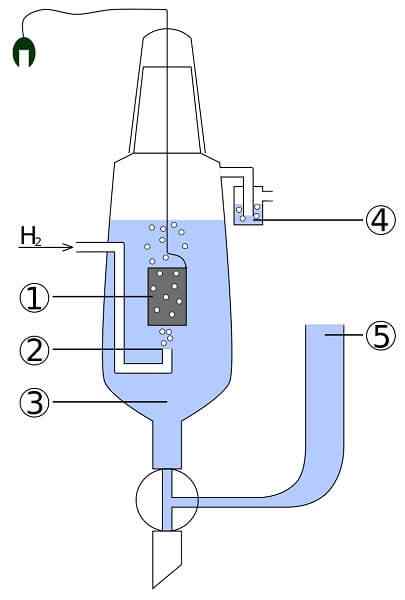 Skim sel platinum dan hidrogen: 1. 2 Platinum Electrode. Gas hidrogen 3. Penyelesaian Asid 4. Hidroseal 5. Deposit kesatuan
Skim sel platinum dan hidrogen: 1. 2 Platinum Electrode. Gas hidrogen 3. Penyelesaian Asid 4. Hidroseal 5. Deposit kesatuan Bayangkan sel yang menggunakan hidrogen gas, menghasilkan perak logam, dan pada masa yang sama memerlukan elektrik. Ini adalah sel platinum dan hidrogen, dan tindak balas umumnya adalah seperti berikut:
2AGCL (s) + h2(g) → 2AG (s) + 2H+ + 2Cl-
Di sini di petak anod kita mempunyai elektrod platinum lengai, tenggelam di dalam air dan yang mana hidrogen gas dipam. H2 Dapatkan teroksida ke h+ dan menghasilkan elektronnya kepada endapan susu Agcl dalam petak katod dengan elektrod perak logam. AGCL akan dikurangkan pada perak ini dan adunan elektrod akan meningkat.
Sel ini boleh diwakili sebagai:
Pt, h2 | H+ | | Cl-, AGCL | Ag
Downs Cell
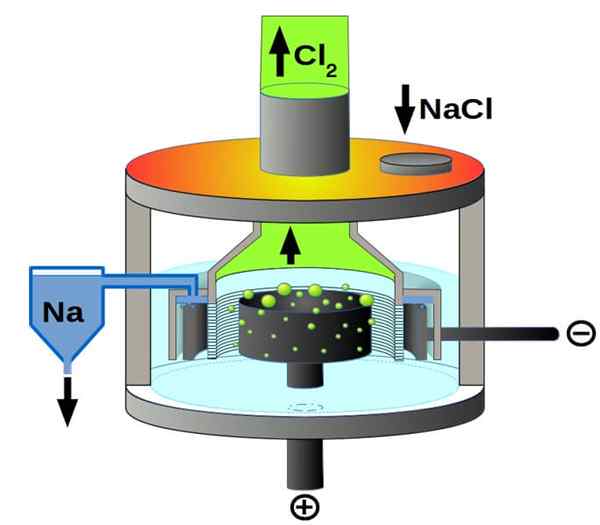 Skim sel Downs untuk elektrolisis natrium klorida. Sumber: Pchemiker, CC BY-SA 4.0, melalui Wikimedia Commons
Skim sel Downs untuk elektrolisis natrium klorida. Sumber: Pchemiker, CC BY-SA 4.0, melalui Wikimedia Commons Dan akhirnya, di antara sel -sel elektrolisis kita mempunyai natrium klorida cair, lebih dikenali sebagai Downs Cell. Di sini elektrik dibuat untuk mengembara melalui elektrod jumlah naCl cair, dan dengan itu berasal dari mereka reaksi berikut:
2+(l) + 2e- → 2NA (s) (katod)
2Cl-(L) → Cl2(g) + 2e- (anod)
2nacl (l) → 2NA (s) + cl2(g) (reaksi global)
Oleh itu, terima kasih kepada elektrik dan natrium klorida, natrium logam dan gas klorin boleh disediakan.

