Struktur asid kromik, sifat, mendapatkan, menggunakan

- 1663
- 385
- Delbert Dare
Dia Asid kromik atau h2Cro4 Asid yang dikaitkan dengan kromium oksida (VI) atau CRO cromic oksida secara teorinya3. Denominasi ini disebabkan oleh fakta bahawa dalam larutan akueus berasid dari oksida kromik spesies h2Cro4 Ia hadir dengan spesies kromium lain (vi).
CROMIC OXIDE3 Ia juga dipanggil asid kromik anhydrous. CRO3 Ia adalah pepejal coklat kemerahan atau ungu yang diperolehi semasa merawat penyelesaian kalium dikromat k2Cr2Sama ada7 Dengan asid sulfurik h2SW4.
 Cromic Oxide Crushes3 Dalam periuk lebur. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikipedia Commons.
Cromic Oxide Crushes3 Dalam periuk lebur. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikipedia Commons. Penyelesaian oksida kromik berair mengalami keseimbangan spesies kimia tertentu yang kepekatannya bergantung pada pH penyelesaian. Asas pH mendominasi cro cro cro42-, Sementara ion asid hcro mendominasi4- dan cr dicromato2Sama ada72-. Dianggarkan bahawa asid asid juga ada asid kromik h2Cro4.
Oleh kerana kuasa pengoksidaannya yang hebat, penyelesaian asid kromik digunakan dalam kimia organik untuk melakukan tindak balas pengoksidaan. Mereka juga digunakan dalam proses elektrokimia untuk merawat logam sehingga mereka memperoleh ketahanan terhadap kakisan dan memakai.
Bahan polimer tertentu juga dirawat dengan asid kromik untuk meningkatkan lekatan mereka kepada logam, lukisan dan bahan lain.
Penyelesaian asid kromik sangat berbahaya bagi kedua -dua manusia dan kebanyakan haiwan dan persekitaran. Atas sebab ini, sisa proses cecair atau pepejal di mana asid kromik digunakan dirawat untuk menghapuskan krom (vi) kekal atau untuk memulihkan semua krom dan asid kromik semula sekarang untuk menggunakannya semula.
[TOC]
Struktur
Molekul asid kromik h2Cro4 Ia dibentuk oleh cro cro ion42- dan dua ion hidrogen h+ Bersatu dengan ini. Dalam ion kromat, elemen kromium berada dalam keadaan pengoksidaan +6.
Struktur spatial ion kromat adalah tetrahedral, di mana kromium berada di tengah dan oksigen menduduki empat titik tetrahedron.
Dalam atom hidrogen asid kromik masing -masing bersebelahan dengan oksigen. Daripada empat ikatan kromium dengan atom oksigen, dua dua dan dua adalah mudah, kerana mereka mempunyai hidrogen yang bersatu dengan mereka.
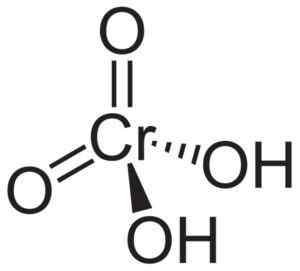 Struktur asid kromik h2Cro4 di mana bentuk tetrahedral kromat dan ikatan berganda diperhatikan. Neuroteker [domain awam]. Sumber: Wikipedia Commons.
Struktur asid kromik h2Cro4 di mana bentuk tetrahedral kromat dan ikatan berganda diperhatikan. Neuroteker [domain awam]. Sumber: Wikipedia Commons. Sebaliknya, CRO -CROOMIC OXIDE3 Ia mempunyai atom krom pengoksidaan +6 dikelilingi oleh hanya tiga atom oksigen.
Nomenclature
- Asid cromik h2Cro4
- Asid tetraoxochromic h2Cro4
- CRO CROMIC OXIDE (Asid Kromik Anhydrous) CRO3
- Kromium trioksida (asid kromik anhydrous) CRO3
Sifat
Keadaan fizikal
Asid kromik anhydro atau kromik oksida adalah pepejal kristal ungu ke merah
Berat molekul
Cro3: 118.01 g/mol
Takat lebur
Cro3: 196 ºC
Di atas titik leburnya tidak stabil, ia kehilangan oksigen (ia dikurangkan) untuk memberikan kromium oksida (III) cr2Sama ada3. Ia terurai pada kira -kira 250 ºC.
Ketumpatan
Cro3: 1.67-2,82 g/cm3
Kelarutan
CRO3 Ia sangat larut dalam air: 169 g/100 g air pada 25 ºC.
Ia larut dalam asid mineral seperti sulfur dan nitrik. Larut alkohol.
Sifat lain
CRO3 Ia sangat hygroscopic, kristalnya sedap.
Apabila CRO3 Ia larut dalam bentuk air yang kuat penyelesaian berasid.
Boleh melayani anda: Titanium: Sejarah, Struktur, Hartanah, Reaksi, KegunaanIa adalah oksidan yang sangat kuat. Oxy dengan kuat bahan organik dalam hampir semua bentuknya. Menyerang kain, kulit dan beberapa plastik. Kebanyakan logam juga menyerang.
Ia sangat beracun dan sangat menjengkelkan kerana potensi pengoksidaan yang tinggi.
Kimia penyelesaian berair di mana asid kromik hadir
CROMIC OXIDE3 Ia larut dengan cepat di dalam air. Dalam penyelesaian berair Chrome (vi) boleh wujud dalam bentuk ionik yang berbeza.
Ph> 6.5 atau dalam larutan alkali krom (vi) memperoleh bentuk ion cromato42- kuning.
Sekiranya pH berkurangan (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , yang boleh dimerize ke ion dicroomato cr2Sama ada72-, Dan penyelesaiannya menjadi oren. Pada pH antara 2.5 dan 5.5 spesies utama adalah HCRO4- dan Cr2Sama ada72-.
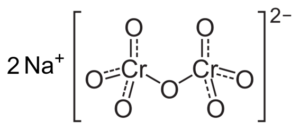 Struktur ion cr dikromat2Sama ada72- yang bersebelahan dengan dua ion natrium+. Kapasi [cc by-sa 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikipedia Commons.
Struktur ion cr dikromat2Sama ada72- yang bersebelahan dengan dua ion natrium+. Kapasi [cc by-sa 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikipedia Commons. Baki yang berlaku dalam penyelesaian ini apabila pH turun adalah yang berikut:
Cro42- (ion kromat) + h+ ⇔ Hcro4-
Hcro4- + H+ ⇔ h2Cro4 (Asid Kromik)
2Hcro4- ⇔ cr2Sama ada72- (Dicromate ion) + h2Sama ada
Baki ini hanya berlaku jika asid yang ditambah untuk menurunkan pH3 atau hclo4, kerana dengan asid lain sebatian yang berbeza terbentuk.
Penyelesaian berasid dikromat adalah agen pengoksidaan yang sangat bertenaga. Tetapi dalam penyelesaian alkali ion kromat adalah kurang oksida.
Memperoleh
Menurut sumber yang dirujuk, salah satu cara untuk mendapatkan CRO CROMIC OXIDE3, Ini terdiri daripada menambahkan asid sulfurik kepada larutan natrium atau kalium dikromat, membentuk endapan merah oren.
 Oksida kromik terhidrat atau asid kromik. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikipedia Commons.
Oksida kromik terhidrat atau asid kromik. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikipedia Commons. Asid cromik h2Cro4 Ia terdapat dalam penyelesaian oksida kromik berair dalam medium berasid.
Asid kromik menggunakan
Dalam pengoksidaan sebatian kimia
Oleh kerana kapasiti pengoksidaannya yang kuat, asid kromik telah digunakan untuk masa yang lama dan berjaya mengoksidakan sebatian organik dan bukan organik.
Antara contoh yang tidak terhitung adalah seperti berikut: ia membolehkan pengoksidaan alkohol utama ke aldehid dan ini kepada asid karboksilik, alkohol sekunder kepada keton, toluena kepada asid benzoik, etilbenzena kepada acetophenone, trifenylmetano kepada trifenylcarbinol, asid formik2, asid oksalik ke co2, Asid laktik ke acetaldehid dan Co2, Iman ferus2+ Kepercayaan Ferric Faith3+, ion iodida ke iodin, dll.
Membolehkan penukaran nitrous-komprehensif kepada nitro-compounds, sulfides ke sulfon. Ia campur tangan dalam sintesis keton berdasarkan alkenes, seperti yang dioksidakan alkena yang hidroborated ke keton.
Sebatian sangat tahan terhadap oksidan biasa, seperti oksigen atau2 atau hidrogen peroksida h2Sama ada2, Mereka dioksidakan oleh asid kromik. Ini adalah kes benteng heterosiklik tertentu.
Dalam proses anodisasi logam
Anodisasi asid kromik adalah rawatan elektrokimia yang digunakan untuk aluminium untuk melindunginya selama bertahun -tahun dari pengoksidaan, kakisan dan haus.
Proses anodisasi melibatkan pembentukan elektrokimia lapisan aluminium oksida atau alumina pada logam. Lapisan ini kemudian dimeteraikan dalam air panas, yang dicapai dengan penukaran kepada aluminium oksida trihydrated.
Lapisan oksida tertutup tebal, tetapi ia lemah secara struktur dan tidak memuaskan untuk kesatuan pelekat berikutnya. Walau bagaimanapun, dengan menambahkan sedikit asid kromik untuk menyegel air, permukaan dibangunkan yang dapat membentuk ikatan yang baik.
Boleh melayani anda: undang -undang mengenai pemuliharaan bahanAsid kromik dalam pengedap air membubarkan sebahagian daripada struktur sel jenis tebal dan meninggalkan nipis, kuat, tegas dilekatkan pada aluminium oksida, yang mana pelekat melekat dan membentuk sendi yang kuat dan berkekalan.
Anodisasi dengan asid kromik juga terpakai kepada titanium dan aloinya.
Dalam rawatan penukaran kimia
Asid kromik digunakan dalam proses salutan logam oleh penukaran kimia.
Semasa proses ini, logam tenggelam dalam penyelesaian asid kromik. Ini bertindak balas dan larut sebahagiannya permukaan mendepositkan pada masa yang sama lapisan nipis sebatian kromium kompleks yang berinteraksi dengan logam asas.
Proses ini dipanggil salutan penukaran kromat atau krom penukaran.
Logam yang umumnya tertakluk kepada krom penukaran adalah pelbagai jenis keluli, seperti keluli karbon, keluli tahan karat dan keluli bersalut zink, dan beberapa logam bukan ferus, seperti aloi magnesium, aloi timah, aloi aluminium, tembaga, kadmium, Mangan dan perak.
Rawatan ini memberikan ketahanan kakisan dan kecerahan kepada logam. PH yang lebih tinggi dari proses rintangan yang lebih besar terhadap kakisan. Suhu mempercepat tindak balas asid.
Lapisan pelbagai warna boleh digunakan, seperti biru, hitam, emas, kuning dan telus. Ia juga menyediakan pematuhan permukaan logam yang lebih baik ke arah lukisan dan pelekat.
Di permukaan terkikis atau dicincang
Penyelesaian asid kromik digunakan dalam penyediaan permukaan bahan termoplastik, polimer thermosystable dan elastomer untuk salutan kemudian dengan lukisan atau pelekat.
H2Cro4 mencapai kesan pada kimia permukaan dan strukturnya, kerana ia membantu meningkatkan kekasarannya. Gabungan gigitan dan pengoksidaan meningkatkan penembusan pelekat dan bahkan dapat menyebabkan perubahan dalam sifat polimer.
Ia telah digunakan untuk mengikis polietilena bercabang dengan ketumpatan rendah, ketumpatan tinggi dan polypropylene linear polyethylene.
Ia banyak digunakan dalam industri elektro atau industri galvaneplasti untuk memudahkan lekatan logam-polimer.
Dalam beberapa kegunaan
Asid kromik digunakan sebagai pengawet kayu, juga dalam bahan magnet dan untuk reaksi kimia pemangkinan.
Pemulihan asid krom
Terdapat banyak proses yang menggunakan asid kromik dan menghasilkan arus atau sisa yang mengandungi krom (III) yang tidak dapat dibuang kerana mereka mempunyai ion krom (vi) yang sangat toksik, atau digunakan semula kerana kepekatan ion kromat adalah sangat rendah.
Pelupusannya memerlukan pengurangan kimia kromat kepada kromium (iii), diikuti oleh hidroksida dan pemendakan penapisan, yang menghasilkan kos tambahan.
Atas sebab ini, pelbagai kaedah telah dikaji untuk menghapuskan dan memulihkan kromat. Berikut adalah beberapa perkara ini.
Melalui penggunaan resin
Selama bertahun -tahun, resin pertukaran ion untuk rawatan air tercemar kromat telah digunakan. Ini adalah salah satu rawatan yang diluluskan oleh Agensi Perlindungan Alam Sekitar AS, atau EPA (akronim untuk Bahasa Inggeris Agensi Perlindungan Alam Sekitar).
Kaedah ini membolehkan pemulihan asid kromik pekat kerana ia diperbaharui semula dari resin.
Resin boleh menjadi asas yang kuat atau lemah. Dalam resin yang sangat asas, kromat boleh dikeluarkan sebagai ion hcro4- dan Cr2Sama ada72- Mereka ditukar dengan ion oh- dan Cl-. Dalam resin asas yang lemah, contohnya sulfat, ion ditukar dengan SOS42-.
Boleh melayani anda: nepelometriDalam hal resin yang sangat asas r- (OH), reaksi global adalah seperti berikut:
2roh + hcro4- + H+ ⇔ r2Cro4 + 2h2Sama ada
R2Cro4 + 2Hcro4- ⇔ 2rhcro4 + Cro42-
R2Cro4 + Hcro4- + H+ ⇔ r2Cr2Sama ada7 + H2Sama ada
Untuk setiap mol r r2Cro4 Menukar satu mol Cr (vi) penyelesaian dikeluarkan, yang menjadikan kaedah ini sangat menarik.
Setelah penyingkiran kromat, resin dirawat dengan penyelesaian alkali yang kuat untuk menjana semula mereka di tempat yang selamat. Kemudian kromat ditukarkan kepada asid kromik pekat untuk digunakan semula.
Melalui regenerasi elektrokimia
Kaedah lain ialah regenerasi elektrokimia asid kromik, yang juga merupakan alternatif yang sangat mudah. Melalui prosedur ini, Chrome (III) dioksidakan secara oksida kepada Chrome (VI). Bahan anod dalam kes ini lebih disukai memimpin dioksida.
Penggunaan mikroorganisma untuk membersihkan efluen dengan asid kromik kekal
Kaedah yang telah disiasat dan masih dalam kajian adalah penggunaan mikroorganisma yang hadir secara semulajadi dalam efluen tertentu yang tercemar dengan ion krom heksavalen yang merupakan kandungan dalam penyelesaian asid kromik.
 Efluen yang berbahaya bagi alam sekitar. Pengarang: OpenClipart-Vectors. Sumber: Pixabay.
Efluen yang berbahaya bagi alam sekitar. Pengarang: OpenClipart-Vectors. Sumber: Pixabay. Begitu juga bakteria tertentu yang terdapat di perairan air sisa penyamakan. Mikroba ini telah dikaji dan ditentukan bahawa mereka tahan kromat dan juga dapat mengurangkan krom (vi) ke krom (iii) yang jauh lebih berbahaya kepada alam sekitar dan makhluk hidup.
Atas sebab ini, dianggarkan bahawa mereka boleh digunakan sebagai kaedah yang mesra alam untuk pemulihan dan detoksifikasi efluen yang tercemar dengan asid kromik kekal.
Risiko asid kromik dan oksida kromik
CRO3 Ia bukan bahan bakar tetapi dapat meningkatkan pembakaran bahan lain. Banyak reaksi anda boleh menyebabkan kebakaran atau letupan.
CRO3 dan penyelesaian asid kromik adalah kulit yang menjengkelkan yang kuat (mereka boleh menyebabkan dermatitis), mata (boleh membakarnya) dan membran mukus (boleh menyebabkan bronchasma) dan boleh menyebabkan "hollows krom" yang dipasang di dalam sistem pernafasan.
Sebat.
Rujukan
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Asid kromik. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Wegman, r.F. dan Van Twisk, J. (2013). Aloi aluminium dan aluminium. 2.5. Proses anodize asid kromik. Dalam teknik penyediaan permukaan untuk ikatan pelekat (edisi kedua). Pulih dari Scientedirect.com.
- Wegman, r.F. dan Van Twisk, J. (2013). Magnesium. 6.4. Penyediaan aloi magnesium dan magnesium oleh proses rawatan asid kromik. Dalam teknik penyediaan permukaan untuk ikatan pelekat (edisi kedua). Pulih dari Scientedirect.com.
- Grot, w. (2011). Aplikasi. 5.1.8. Penjanaan semula asid kromik. Dalam ionomer fluorinated (edisi kedua). Pulih dari Scientedirect.com.
- Swift, k.G. dan Booker, J.D. (2013). Proses kejuruteraan permukaan. 9.7. Kromat. Dalam Buku Panduan Pemilihan Proses Pembuatan. Pulih dari Scientedirect.com.
- Poulson, a.H.C. et al. (2019). Teknik pengubahsuaian permukaan mengintip, termasuk rawatan permukaan plasma. sebelas.3.2.1. Etching permukaan. Dalam Buku Panduan Peek Biomaterials (edisi kedua). Pulih dari Scientedirect.com.
- Westheimer, f.H. (1949). Mekanisme pengoksidaan asid kromik. Ulasan Kimia 1949, 45, 3, 419-451. Pulih dari pub.ACS.org.
- Tan, h.K.S. (1999). Semula Asid Kromis dengan pertukaran anion. Jurnal Kejuruteraan Kimia Kanada, Jilid 77, Februari 1999. Diperolehi dari perpustakaan dalam talian.Wiley.com.
- Kabir, m.M. et al. (2018). Pengasingan dan ciri -ciri bakteria kromium (VI) yang mengurangkan efluen penyamakan dan buangan pepejal. Jurnal Dunia Mikrobiologi dan Bioteknologi (2018) 34: 126. NCBI pulih.NLM.NIH.Gov.
- « Ciri, elemen dan contoh landskap perindustrian
- Struktur molekul asid cyanhydric, sifat, kegunaan »

