Struktur molekul asid cyanhydric, sifat, kegunaan

- 4939
- 1473
- Anthony Breitenberg
Dia asid hidrocyanic o Hidrogen Cyanide adalah sebatian organik yang formula kimianya adalah HCN. Ia juga dikenali sebagai metanonitril.
Asid cyanhydric adalah gas yang tidak berwarna, sangat beracun, yang diperoleh ketika merawat sianida dengan asid. Asid ini terletak di dalam benih yang tidak dikenali, juga dikenali di banyak tempat sebagai persik.
 Benih Peach, yang mengandungi sianida sianida atau hidrogen hidrogen, HCN. An.HA [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikipedia Commons.
Benih Peach, yang mengandungi sianida sianida atau hidrogen hidrogen, HCN. An.HA [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikipedia Commons. Pada suhu ambien kurang daripada 25 ºC adalah cecair dan di atas suhu itu adalah gas. Dalam kedua -dua kes, ia sangat toksik kepada manusia, haiwan dan bahkan majoriti mikroorganisma yang tidak disesuaikan dengannya. Ia adalah pelarut yang baik untuk ion. Ia sangat tidak stabil kerana ia cenderung dengan mudah dipolimerisasi.
Ia terdapat di dalam kerajaan sayur -sayuran yang dimasukkan dalam molekul beberapa glukosida, kerana apabila ia dihidrolisis oleh enzim sayur -sayuran, HCN, glukosa dan benzaldehid diperolehi.
Glukosida ini berada di dalam benih buah -buahan tertentu seperti persik, aprikot, ceri, plum dan badam pahit, jadi mereka tidak boleh ditelan.
Ia juga terdapat di tumbuh -tumbuhan seperti beberapa jenis sorghum. Di samping itu, beberapa bakteria menghasilkannya semasa metabolisme mereka. Kebanyakannya digunakan dalam pengeluaran polimer dan dalam beberapa proses metalurgi.
HCN adalah racun maut kerana penyedutan, pengambilan dan hubungan. Ia terdapat di asap rokok dan di asap api plastik dan bahan yang mengandungi karbon dan nitrogen. Ia dianggap sebagai bahan pencemar udara yang berlaku semasa pembakaran bahan organik dari kawasan luas di planet ini.
[TOC]
Struktur molekul dan konfigurasi elektronik
Asid sianida hidrogen atau sianida adalah sebatian kovalen, molekul, dengan atom hidrogen, karbon dan salah satu nitrogen.
Atom karbon dan nitrogen berkongsi 3 pasang elektron, jadi mereka membentuk pautan tiga. Hidrogen dikaitkan dengan karbon, yang dengan kesatuan ini membentangkan valencia de cuatro dan oktet elektron lengkapnya.
Nitrogen membentangkan lima valencia lima dan untuk melengkapkan oktetnya mempunyai sepasang elektron yang hilang atau sunyi yang terletak di sebelahnya.
Oleh itu, HCN adalah molekul linear yang benar -benar, dengan beberapa elektron hilang yang terletak pada nitrogen.
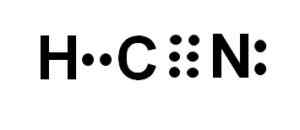 Lewis Perwakilan Asid Cyanhydric, di mana elektron dikongsi dalam setiap ikatan dan sepasang elektron nitrogen kesepian diperhatikan. Pengarang: Marilú Stea.
Lewis Perwakilan Asid Cyanhydric, di mana elektron dikongsi dalam setiap ikatan dan sepasang elektron nitrogen kesepian diperhatikan. Pengarang: Marilú Stea. 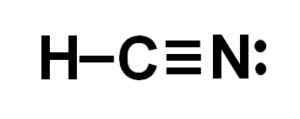 Struktur sianida hidrogen atau hidrogen sianida di mana ikatan tiga antara karbon dan nitrogen diperhatikan. Pengarang: Marilú Stea.
Struktur sianida hidrogen atau hidrogen sianida di mana ikatan tiga antara karbon dan nitrogen diperhatikan. Pengarang: Marilú Stea. Nomenclature
- Asid hidrocyanic
- Hidrogen sianida
- Metanonitrile
- Formonitrile
- Asid hidrocyanic
Sifat
Keadaan fizikal
Di bawah 25.6 ºC, jika ia adalah anhidrat dan stabil, ia adalah cecair biru atau biru pucat yang sangat tidak stabil dan toksik. Sekiranya di atas suhu itu adalah gas berwarna yang sangat beracun.
Berat molekul
27.03 g/mol
Takat lebur
-13.28 ºC
Takat didih
25.63 ºC (perhatikan bahawa ia mendidih di atas suhu ambien).
Titik kilat
-18 ºC (kaedah cawan tertutup)
Suhu arah diri
538 ºC
Boleh melayani anda: kromatografi gasKetumpatan
0.6875 g/cm3 pada 20 ºC
Kelarutan
Sama sekali boleh dilarutkan dengan air, etil alkohol dan etil eter.
Pemisahan pemalar
K = 2.1 x 10-9
Pkke = 9.2 (ia adalah asid yang sangat lemah)
Beberapa sifat kimia
HCN mempunyai pemalar dielektrik yang sangat tinggi (107 hingga 25 ° C). Ini kerana molekul mereka sangat kutub dan dikaitkan dengan jambatan hidrogen, seperti dalam kes air h2Sama ada.
Kerana mempunyai pemalar dielektrik yang tinggi, HCN ternyata menjadi pelarut pengion yang baik.
HCN anhydrous cecair sangat tidak stabil, ia cenderung memolimunkan ganas. Untuk mengelakkan ini, penstabil ditambah, sebagai peratusan kecil h2SW4.
Dalam larutan akueus dan di hadapan ammonia dan bentuk adenine tekanan tinggi, kompaun yang merupakan sebahagian daripada DNA dan RNA, iaitu, molekul penting secara biologi.
Ia adalah asid yang sangat lemah, kerana pemalar pengionannya sangat kecil, jadi sebahagiannya hanya di dalam air yang memberikan anion sianida CN-. Bentuk garam dengan pangkalan tetapi tidak dengan karbonat.
Penyelesaian berairnya yang tidak dilindungi dari cahaya perlahan -lahan diuraikan menghasilkan ammonium formiatri hcoonh4.
Dalam penyelesaiannya ia memberikan bau badam yang lemah.
Korosiviti
Kerana ia adalah asid yang lemah, biasanya tidak mengakis.
Walau bagaimanapun, larutan akueus HCN yang mengandungi asid sulfurik sebagai penstabil kuat menyerang keluli pada suhu yang lebih besar daripada 40 ºC dan keluli tahan karat pada suhu lebih besar daripada 80 ° C.
Di samping itu, penyelesaian berair HCN boleh menyebabkan keluli karbon walaupun pada suhu bilik.
Anda juga boleh menyerang beberapa jenis getah, plastik dan salutan.
Lokasi di Alam
Ia agak banyak di kerajaan tumbuhan menjadi sebahagian daripada glukosida.
Contohnya, ia dihasilkan dari tonsilin c6H5-CH (-CN) -O-GLYCOSE-GLYCOSE, Kompaun hadir dalam badam pahit. Tonsil adalah beta-glukosida sianogenik, kerana apabila dihidrolisiskan ia membentuk dua molekul glukosa, salah satu benzaldehid dan salah satu HCN. Enzim yang melepaskan mereka adalah beta-glucoxidase.
Tonsil boleh didapati di benih persik, aprikot, badam pahit, ceri dan plum.
Beberapa jenis tumbuhan sorgum mengandungi glucóside sianogenik yang dipanggil durrina (iaitu, p-hydroxy- (S) -Mandelonitrilo-beta-d-glucoside). Kompaun ini boleh direndahkan oleh hidrolisis enzimatik dua langkah.
Pertama, enzim durrinosa yang endogen dalam tumbuhan sorghum hidrolys dengan glukosa dan p-hydroxy- (S) -Mandelonitrilo. Kemudian, yang terakhir dengan cepat menjadi HCN dan p-hydroxibenzaldehyde percuma.
 Loji sorgum dengan kandungan durrina yang tinggi. Tiada pengarang yang boleh dibaca mesin yang disediakan. Pethan diasumsikan (berdasarkan tuntutan hak cipta). [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Sumber: Wikipedia Commons.
Loji sorgum dengan kandungan durrina yang tinggi. Tiada pengarang yang boleh dibaca mesin yang disediakan. Pethan diasumsikan (berdasarkan tuntutan hak cipta). [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Sumber: Wikipedia Commons. HCN bertanggungjawab terhadap rintangan tumbuhan sorgum ke arah perosak dan patogen.
Ini dijelaskan oleh fakta bahawa enzim Durrina dan Durrinosa mempunyai lokasi yang berbeza di dalam tumbuhan ini, dan hanya bersentuhan apabila tisu -tisu cedera atau dimusnahkan, melepaskan HCN dan melindungi tumbuhan jangkitan yang dapat menembusi parti yang cedera.
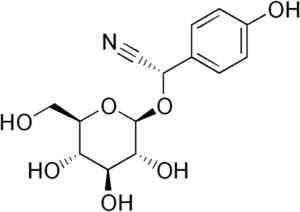 Molekul Durrina di mana ikatan Triple CN diperhatikan bahawa oleh hidrolisis enzimatik menghasilkan HCN. Edgar181 [domain awam]. Sumber: Wikipedia Commons.
Molekul Durrina di mana ikatan Triple CN diperhatikan bahawa oleh hidrolisis enzimatik menghasilkan HCN. Edgar181 [domain awam]. Sumber: Wikipedia Commons. Di samping itu, beberapa bakteria patogen manusia seperti Pseudomonas aeruginosa dan P. Gingivalis Mereka menghasilkannya semasa aktiviti metabolik mereka.
Aplikasi
Dalam penyediaan sebatian kimia dan polimer lain
Penggunaan yang melibatkan kebanyakan HCN yang dihasilkan di peringkat perindustrian adalah penyediaan perantara untuk sintesis organik.
Boleh melayani anda: Besi oksida (ii): struktur, nomenclature, sifat, kegunaanIa digunakan dalam sintesis adiponitril nc- (ch2)4-CN, yang digunakan untuk menyediakan nilon atau nilon, poliamida. Ia juga berfungsi untuk menyediakan acrilonitrilo atau cianoethylene cho2= CH-CN, digunakan untuk menyediakan serat akrilik dan plastik.
Natrium sianida derivatif digunakan untuk pemulihan emas dalam perlombongan logam ini.
Satu lagi derivatif clcn cyanogen chloride berfungsi untuk formula racun perosak.
HCN digunakan untuk penyediaan agen chelating seperti EDTA (Ethylen-Diamino-Tetra-Acetato).
Ia berfungsi untuk pembuatan ferrocyanides dan beberapa produk farmaseutikal.
Pelbagai kegunaan
Gas HCN telah digunakan sebagai racun serangga, fungisida dan pembasmi kuman, untuk pengasingan kapal dan bangunan. Juga untuk fumigate perabot untuk memulihkannya.
HCN telah digunakan dalam menggilap logam.
Kerana ketoksikannya yang sangat tinggi, dia dilantik sebagai ejen perang kimia.
Dalam bidang pertanian
Ia telah digunakan sebagai herbisida dan racun perosak di kebun. Dia telah menggunakan untuk mengawal skala dan patogen pokok sitrus yang lain, tetapi beberapa perosak ini menjadi tahan terhadap HCN.
Ia juga telah digunakan untuk mengasingkan silo bijirin. HCN gas yang disediakan di tapak telah digunakan dalam pengasingan bijirin gandum untuk memelihara mereka dari perosak seperti serangga, kulat dan tikus. Untuk kegunaan ini adalah penting bahawa benih akan fumigasi kepada ejen racun perosak.
Ujian Fumigating Benih Gandum telah dilakukan dengan HCN dan didapati bahawa potensi percambahan ini tidak memberi kesan negatif, sebaliknya ia menyukainya.
Walau bagaimanapun, dos tinggi HCN dapat mengurangkan panjang daun kecil yang tumbuh dari benih.
Sebaliknya, disebabkan oleh fakta bahawa ia adalah nematicide yang kuat dan bahawa beberapa tumbuhan sorgum memilikinya dalam tisu mereka, potensi tumbuhan sorghum sedang disiasat untuk digunakan sebagai baja hijau biokid.
Penggunaannya akan berfungsi untuk memperbaiki tanah, menindas rumpai dan mengawal penyakit dan kerosakan yang disebabkan oleh nematoda phytoparasitic.
Risiko
Bagi manusia, HCN adalah racun maut di semua laluan: penyedutan, pengambilan dan hubungan.
 Pengarang: Imej-vektor bebas-clker. Sumber: Pixabay.
Pengarang: Imej-vektor bebas-clker. Sumber: Pixabay. Disedut boleh mematikan. Dianggarkan bahawa kira-kira 60-70% penduduk dapat mengesan bau badam hcn pahit ketika berada di udara pada kepekatan 1-5 ppm.
Tetapi terdapat 20% penduduk yang masih belum dapat mengesannya pada kepekatan maut kerana secara genetik tidak dapat melakukannya.
Ditemankan adalah racun tindakan akut dan segera.
Sekiranya penyelesaian anda bersentuhan dengan kulit, sianida yang berkaitan boleh mematikan.
HCN hadir dalam asap rokok dan yang dihasilkan apabila plastik yang mengandungi nitrogen dibakar.
Mekanisme tindakan maut dalam organisma
Ia adalah bahan kimia dan cepat toksik, sering menyebabkan kematian. Apabila memasuki organisma, ia bergabung. Ia adalah ejen toksik untuk beberapa organ tubuh manusia
Kesan toksik utamanya terdiri daripada perencatan pernafasan selular, kerana ia menyahaktifkan enzim yang mempengaruhi fosforilasi dalam mitokondria, yang merupakan organel yang campur tangan, antara lain, dalam fungsi pernafasan sel.
Boleh melayani anda: kalium permanganat (kmno4)Risiko asap rokok
HCN hadir dalam asap rokok.
Walaupun ramai orang tahu kesan keracunan HCN, beberapa orang menyedari bahawa mereka terdedah kepada kesan berbahaya mereka melalui asap rokok.
HCN adalah salah satu punca perencatan beberapa enzim pernafasan sel. Jumlah HCN yang terdapat dalam asap rokok mempunyai kesan berbahaya pada sistem saraf.
Tahap HCN telah dilaporkan dalam asap rokok antara 10 dan 400 μg setiap rokok untuk asap secara langsung dan 0.006 hingga 0.27 μg/rokok untuk penyedutan sekunder (perokok pasif). HCN menghasilkan kesan toksik dari 40 μm dan seterusnya.
 Pengarang: Foto Alexas. Sumber: Pixabay.
Pengarang: Foto Alexas. Sumber: Pixabay. Disedut dengan cepat memasuki aliran darah, di mana dia dibebaskan dalam plasma atau mengikat hemoglobin. Sebahagian kecil menukar ke tiocianato dan dikeluarkan oleh air kencing.
Risiko pemanasan HCN
Pendedahan berpanjangan kepada haba HCN cecair dalam bekas tertutup boleh menyebabkan pecahnya ganas dan tidak dijangka ini. Ia boleh memolimunkan 50-60 ºC dengan letupan dengan kehadiran jejak alkali dan tanpa ketiadaan perencat.
Kehadiran HCN dalam asap api
HCN dibebaskan semasa pembakaran polimer yang mengandungi nitrogen, seperti bulu, sutera, polyacrylonitrilos dan nilon, antara lain. Bahan -bahan ini terdapat di rumah kita dan di kebanyakan tapak aktiviti manusia.
Atas sebab ini semasa kebakaran HCN berpotensi menjadi punca kematian dengan penyedutan.
Atmosfer Pencemar
HCN adalah bahan pencemar troposfera. Ia tahan terhadap photólysis dan di bawah keadaan persekitaran atmosfera tidak mengalami hidrolisis.
OH Hydroxyl Radicals • Dihasilkan secara fotokimia boleh bertindak balas dengan HCN, tetapi tindak balasnya sangat perlahan, jadi separuh hayat HCN di atmosfera adalah 2 tahun.
Apabila biomassa terbakar, terutamanya kumpulan, HCN dilepaskan ke atmosfera, dan juga semasa aktiviti perindustrian. Walau bagaimanapun, pembakaran gambut adalah 5 hingga 10 kali lebih banyak mencemarkan daripada membakar jenis biomas lain.
Sesetengah penyelidik mendapati bahawa suhu tinggi dan kemarau yang disebabkan oleh fenomena El Niño di kawasan tertentu di planet Exacerb.
 Pengarang: Steve Buissinne. Sumber: Pixabay.
Pengarang: Steve Buissinne. Sumber: Pixabay. Ini membawa kepada pembakaran biomas yang kuat di stesen kering.
Peristiwa -peristiwa ini adalah sumber kepekatan tinggi HCN di troposfera, yang akhirnya diangkut ke stratosfera yang rendah, tinggal untuk masa yang sangat lama.
Rujukan
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Hidrogen sianida. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Gidlow, d. (2017). Hidrogen Cyanide-Kemas kini. Perubatan Pekerjaan 2017; 67: 662-663. NCBI pulih.NLM.NIH.Gov.
- Ensiklopedia saintifik Van Nostrand. (2005). Hidrogen sianida. 9th Diperolehi dari perpustakaan dalam talian.Wiley.com.
- Ren, dan.-L. et al. (Sembilan belas sembilan puluh enam). Kesan hidrogen sianida dan sulfida karbonyl pada percambahan dan plumule semangat gandum. Racun. Sci. 1996, 47, 1-5. Diperolehi dari perpustakaan dalam talian.Wiley.com.
- Dari Nicola, G.R. et al. (2011). Kepada kaedah analisis mudah untuk penilaian kandungan dhurrin dalam tumbuhan sianogenik untuk kegunaannya di makanan dan biofumigasi. J. Agric. Makanan Chem. 2011, 59, 8065-8069. Pulih dari pub.ACS.org.
- Sheese, ms.Dan. et al. (2017). Peningkatan Global Hidrogen Cyanide di Stratosfera Lower Thouppout 2016. Geophys. Daging lembu. Lett., 44, 5791-5797. Pulih dari Agupubs.Perpustakaan dalam talian.Wiley.com.
- Surleva, a.R. dan Drochioiu, G. (2013). Visualisasi Bahaya Merokok: Penentuan Spektrofotometrik Mudah Hidrogen Sianida dalam Asap Rokok dan Penapis. J. Chem. Pendidikan. 2013, 90, 1654-1657. Pulih dari pub.ACS.org.
- Alarie, dan. et al. (1990). Peranan sianida hidrogen dalam kematian manusia dalam api. Dalam api dan polimer. Bab 3. Siri Simposium ACS. Pulih dari pub.ACS.org.
- « Struktur asid kromik, sifat, mendapatkan, menggunakan
- 8 eksperimen dengan manusia yang sangat kontroversial »

