Apa itu disulfurik apa, struktur, sifat, kegunaan
- 2177
- 666
- Kerry Schmitt
Apakah asid disulfurik?
Dia asid disulfurik Ia adalah salah satu daripada banyak oxoacid sulfur, yang formulanya adalah h2S2Sama ada7. Formula secara eksplisit menunjukkan bahawa terdapat dua atom belerang, dan sebagai namanya juga menunjukkan, mesti ada dua molekul2SW4 hanya satu; Walau bagaimanapun, terdapat tujuh oksigen dan bukannya lapan, jadi sulfur mesti mempunyai tiga.
Asid ini adalah sebagai salah satu komponen utama minyak (atau asid sulfurik asap), yang menjadi bentuk "padat" asid sulfurik. Begitulah dominasi mereka, yang mana ada yang menganggap minyak sebagai sinonim untuk asid disulfurik; yang juga dikenali dengan nama tradisional asid pyrosulfuric.
Dalam imej penerima dengan minyak ditunjukkan, dengan kepekatan sulfur trioksida, jadi3, 20 %. Bahan ini dicirikan dengan berminyak dan tidak berwarna; Walaupun kekuningan atau coklat boleh menjadi kuning bergantung kepada kepekatan SO3 dan kehadiran beberapa kekotoran.
Di atas menceritakan penyertaan SO3 dalam h2S2Sama ada7; iaitu, molekul h2SW4 Bertindak balas dengan salah satu daripada SO3 Untuk membentuk asid disulfurik. Pada masa itu, H2S2Sama ada7 Ia juga boleh ditulis sebagai h2SW4· SW3.
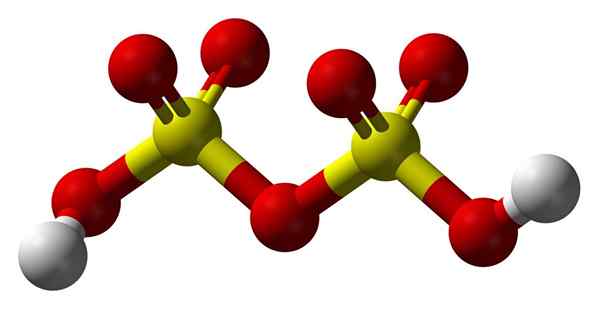
Struktur asid disulfurik
 Struktur asid disulfurik
Struktur asid disulfurik Naik2S2Sama ada7 Dalam model sfera dan bar. Perhatikan simetri molekul: sebelah kiri jambatan oksigen sama dengan kanan. Dari perspektif itu, struktur dapat diterangkan dengan formula ho3Hambar3H.
Di kedua -dua hujungnya adalah setiap kumpulan hidroksil, yang hidrogennya, dengan kesan induktif semua atom oksigen, meningkatkan beban separa positifnya; Dan akibatnya, asid disulfurik mempunyai keasidan yang lebih kuat daripada asid sulfurik.
Boleh melayani anda: kalium hidroksida: struktur, sifat, kegunaanMolekul boleh ditulis sebagai h2SW4· SW3. Walau bagaimanapun, ini merujuk lebih banyak kepada komposisi oleum daripada struktur molekul.
Walau bagaimanapun, jika molekul air ditambah kepada h2S2Sama ada7, Molekul dua h akan dikeluarkan2SW4:
H2S2Sama ada7 + H2Atau 2h2SW4
Baki boleh bergerak ke kiri: ke pembentukan h2S2Sama ada7 Dari h2SW4 Sekiranya haba dibekalkan. Oleh sebab itu untuk h2S2Sama ada7 Ia juga dikenali sebagai asid pyrosulfuric; Oleh kerana ia dapat dihasilkan selepas pemanasan asid sulfurik.
Juga, seperti yang disebutkan pada mulanya, h2S2Sama ada7 Ia dibentuk oleh gabungan langsung h2SW4 Dan juga3:
SW3 + H2SW4 H2S2Sama ada7
Sifat
 Oleum. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], melalui Wikimedia Commons
Oleum. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], melalui Wikimedia Commons Sifat -sifat asid disulfurik tidak jelas, kerana sangat sukar untuk diasingkan semata -mata dari minyak.
Harus diingat bahawa mungkin ada sebatian lain dalam minyak, dengan h h2SW4· XSO3, di mana bergantung kepada nilai x bahkan boleh mempunyai struktur polimer.
Salah satu cara untuk memvisualisasikannya adalah membayangkan bahawa struktur atas h2S2Sama ada7 menjadi lebih panjang oleh lebih banyak unit3 dan jambatan oksigen.
Dalam keadaan hampir tulen ia terdiri daripada pepejal kristal yang tidak stabil (merokok) yang mencairkan pada 36ºC. Walau bagaimanapun, titik lebur ini boleh berbeza -beza bergantung kepada komposisi sebenar.
Asid disulfurik boleh membentuk apa yang dikenali sebagai garam disulfat (atau pyrosulfate). Sebagai contoh, jika anda bertindak balas dengan kalium hidroksida, membentuk kalium pyrosulfate, k2S2Sama ada7.
Di samping+ yang boleh dinetralkan dengan asas yang kuat).
Boleh melayani anda: volatilisasiReaksi dehidrasi gula
Dengan sebatian berbentuk minyak ini, tindak balas yang ingin tahu dapat dijalankan: transformasi ketulan blok karbon.
H2S2Sama ada7 Ia bertindak balas dengan gula yang menghapuskan semua kumpulan OH dalam bentuk air, yang memihak kepada kesatuan baru di kalangan atom karbon; kesatuan yang akhirnya menyebabkan arang batu hitam.
Nomenclature
Asid disulfurik dianggap sebagai anhidrida asid sulfurik; Iaitu, ia kehilangan produk molekul air pemeluwapan antara dua molekul asid. Sebelum begitu banyak nama yang mungkin untuk kompaun ini, tatanama IUPAC hanya mengesyorkan bahawa asid disulfurik.
Istilah 'piro' merujuk secara eksklusif dengan yang terbentuk sebagai produk aplikasi haba. IUPAC tidak menasihatkan nama ini untuk h2S2Sama ada7; Tetapi ia masih digunakan oleh banyak ahli kimia.
Penamatan -Ico kekal tidak dapat diselesaikan kerana atom belerang terus mengekalkan valensi +6. Sebagai contoh, ia boleh dikira oleh operasi aritmetik berikut:
2h + 2s + 7o = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
Aplikasi
Kedai asid sulfurik
Asid disulfurik, memandangkan harta miliknya menguatkan sebagai minyak, mampu membubarkan dan menyimpan asid sulfurik yang lebih selamat. Ini kerana SO3 melarikan diri mencipta "kabus" yang tidak boleh diarahkan, yang lebih larut dalam h2SW4 daripada di dalam air. Untuk mendapatkan h2SW4, Ia cukup untuk menambah minyak air:
H2S2Sama ada7 + H2Atau 2h2SW4
Sintesis Asid Sulfurik 100%
Dari persamaan sebelumnya, h2SW4 Ia dicairkan di dalam air tambahan. Sebagai contoh, jika anda mempunyai larutan akueus H2SW4, Di mana SO3 Ia cenderung untuk melarikan diri dan mewakili risiko pekerja, menambah minyak kepada penyelesaian ini bertindak balas dengan air yang membentuk lebih banyak asid sulfurik; iaitu, meningkatkan kepekatannya.
Ia dapat melayani anda: ketidakmampuan kimiaSekiranya terdapat air yang tersisa, lebih banyak lagi ditambah3, yang bertindak balas dengan h2SW4 untuk menghasilkan lebih banyak asid disulfurik atau minyak, dan kemudian ia menghidrat semula "mengeringkan" h2SW4. Proses ini mengulangi kadang -kadang cukup untuk mendapatkan asid sulfurik pada kepekatan 100%.
Proses yang sama digunakan untuk mendapatkan asid nitrik 100%. Begitu juga, ia telah digunakan untuk menghidrat bahan kimia lain, yang digunakan untuk penjelasan letupan.
Sulfonasi
Struktur, seperti pewarna; iaitu, tambah kumpulan -so3H, yang kehilangan proton asid anda boleh berlabuh ke polimer gentian tekstil.
Sebaliknya, keasidan oleum digunakan untuk mencapai nitrasi kedua (tambah kumpulan -no2) ke cincin aromatik.
Rujukan
- Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Asid pyrosulfuric. Pulih dari: pubchem.NCBI.NLM.NIH.Gov

