Smear bakteria Apa, ciri dan penyediaan
- 1051
- 60
- Donnie Ryan
Dia Smear bakteria Ia adalah lanjutan dalam bentuk filem nipis penggantungan mikroorganisma bakteria yang dibuat pada plat kaca telus atau slaid, untuk pemerhatian di bawah mikroskop optik.
Lanjutan dalam bentuk filem dijalankan untuk memisahkan mikroorganisma sebanyak mungkin, kerana jika pemerhatian dikumpulkan tidak jelas.
Dalam kajian tanaman bakteria, smear, penetapan dan teknik penyediaan pewarnaan digunakan untuk menganalisisnya dengan lebih baik. Kerana saiz kecil mikroorganisma, penggunaan mikroskop optik untuk pemerhatian semestinya diperlukan.
Mikroskop optik adalah instrumen yang sangat diperlukan untuk pemerhatian smear. Ini menggunakan kanta optik dan cahaya yang membolehkan visualisasi sampel dengan peningkatan saiz yang besar.
Secara umum, sel hidup tidak mempunyai struktur berwarna yang besar, pandangan mikroskop optik tidak berwarna, sampel telus, dan menunjukkan sedikit kontras dalaman dan dengan persekitaran mereka.
Pemerhatian dengan mikroskop optik mudah bidang yang jelas, tanpa menggunakan teknik pewarnaan tambahan, sangat terhad dan hanya digunakan dalam beberapa kes, seperti dalam pemerhatian pergerakan mikroorganisma.
Untuk pemerhatian mikroorganisma secara optimum, adalah perlu untuk mencapai keseimbangan antara kontras dan resolusi. Butiran sel tidak dapat diperhatikan di mikroskop, walaupun dengan resolusi tinggi; Penggunaan pewarna melalui teknik pewarnaan diperlukan, yang menyumbang kepada pemerhatian.
Ciri -ciri smear bakteria berkualiti tinggi
Kontras yang sangat baik
Untuk mencapai kontras yang sangat baik terdapat mikroskop canggih yang dipanggil mikroskop kontras fasa, gangguan pembezaan dan mikroskop medan gelap. Jenis mikroskop ini digunakan untuk memerhatikan struktur bakteria seperti pod dan filamen, antara lain.
Pewarnaan adalah teknik mudah untuk meningkatkan kontras yang dicapai dengan mikroskop medan yang jelas. Dalam teknik ini pewarna yang berbeza boleh digunakan yang meningkatkan pemerhatian mikroskop dengan ketara.
Pewarnaan dibuat secara langsung pada smear atau sambungan penggantungan mikroorganisma pada slaid, sebelum ini dikeringkan dan diperbaiki.
Baik tetap
Penetapan adalah teknik yang digunakan untuk memelihara struktur selular; menyebabkan penyahaktifan mikroorganisma dan melekat pada gelas slaid. Terdapat rawatan penetapan yang berbeza: penetapan haba dan penetapan kimia.
Boleh melayani anda: asid palmitholeik: struktur, fungsi, di mana iaPenetapan haba
Ini adalah kaedah yang paling banyak digunakan dalam pemerhatian smear bakteria. Teknik ini terdiri daripada lulus penggantungan bakteria smear oleh api yang lebih ringan. Teknik ini dapat mengekalkan morfologi luaran bakteria, tetapi memusnahkan struktur dalamannya.
Penetapan kimia
Penetapan kimia menggunakan bahan kimia dalam pemeliharaan, seperti formaldehid atau formalin, etanol dan asid asetik, antara lain. Kelebihan menggunakan ejen kimia penetapan adalah bahawa pemeliharaan struktur selular dalaman mikroorganisma dicapai.
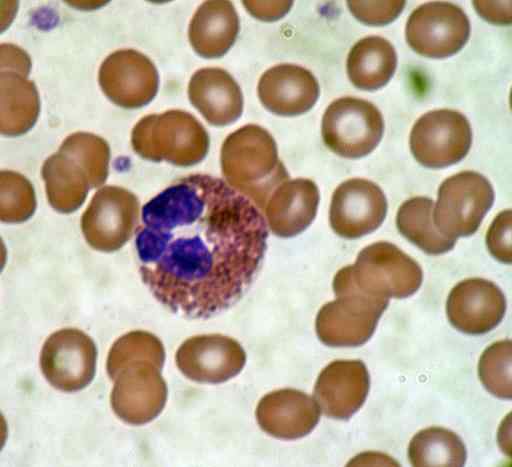
 Smear darah. Sumber: Bobjgalindo [GFDL (http: // www.gnu.Org/copyleft/fdl.html) atau cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons
Smear darah. Sumber: Bobjgalindo [GFDL (http: // www.gnu.Org/copyleft/fdl.html) atau cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons Pewarnaan yang baik
Prosedur yang paling biasa untuk melaksanakan pewarnaan pengeringan yang sebelum ini dan smear tetap adalah pewarnaan positif atau mudah, pewarnaan pembezaan dan pewarnaan negatif. Terdapat juga teknik khas untuk mengotorkan struktur sel tertentu (kapsul, spora, flagella).
Pewarnaan positif atau pewarnaan sederhana
Pewarnaan positif atau sederhana adalah teknik pewarnaan smear yang paling banyak digunakan. Gunakan pewarna yang mempunyai keupayaan untuk menyertai struktur mikrob tertentu, membolehkan mereka memerhatikannya di mikroskop.
Pewarna ini mempunyai kumpulan kromofor (bahagian berwarna) dalam struktur kimia mereka, dengan ikatan berganda alternatif dan ikatan mudah (konjugasi). Pautan ini seterusnya boleh mewujudkan ikatan ionik atau kovalen dengan beberapa struktur selular.
Pewarna yang digunakan dalam pewarnaan positif atau sederhana kebanyakannya derivatif kimia aniline (Garam organik berwarna).
Sebaliknya, di antara pewarna kita dapat mencari beberapa dengan pH asas dan yang lain dengan pH asid.
Pewarna asas
Dalam pewarna asas, kumpulan kromofor mempunyai caj elektrik yang positif. Sebilangan besar mikroorganisma prokariotik mempunyai pH neutral dalaman, dan permukaan sel mereka mempunyai beban negatif. Melalui interaksi elektrostatik ini, kromofor mengikat sel dan pewarna.
Contoh pewarna asas adalah metilena biru, kaca ungu, hijau malachite, fius asas, safranin, antara lain.
Pewarna asid
Dalam pewarna berasid, kumpulan kromofor mempunyai caj elektrik negatif. Ini digunakan untuk pewarnaan protein dengan kumpulan caj positif. Contoh pewarna asid adalah fius asid, bengal mawar, kongo merah dan eosin.
Ia dapat melayani anda: Propage: Apakah, Jenis dan Ciri merekaPewarnaan pembezaan
Teknik pewarnaan pembezaan adalah untuk menggunakan dua pewarna warna atau intensiti yang berbeza, untuk membezakan mikroskop mikroskop. Pewarnaan Gram dan Pewarnaan Rintangan Asid-Alkohol adalah pewarnaan pembezaan yang paling banyak digunakan dalam bakteriologi.
Pewarnaan Gram digunakan sebagai ujian awal untuk mengetahui bentuk, saiz, kumpulan sel, sebagai tambahan kepada jenis dinding sel. Dengan ujian pewarnaan gram, bakteria dinding sel diklasifikasikan sebagai bakteria gram positif dan bakteria negatif gram.
Pewarnaan negatif
Dalam teknik ini, pewarna kimia digunakan yang tidak menembusi pedalaman sel, tetapi membuat medium di mana mikroorganisma muncul sebagai latar belakang hitam.
Dalam teknik pewarnaan negatif, smear disediakan dengan setitik penggantungan dakwat Cina atau nigrosin, yang setelah membenarkan pengeringan pada suhu bilik membentuk filem legap ke laluan cahaya. Dengan cara ini, mikroorganisma diperhatikan sebagai bentuk terang pada latar belakang gelap.
Penyediaan
Ke. Smear
1.- Basuh dengan baik slaid, kering dengan kertas penyerap dan labelkannya. Label mesti menunjukkan kandungan penyediaan, tarikh dan nama mereka yang telah memprosesnya.
2.- Cahaya lebih ringan dan mensterilkan pemegang inokulasi dalam api hingga hidup merah.
3.- Biarkan pemegangnya.
4.- Ambil tiub tanaman bakteria, keluarkan topi dan cepat lulus mulut tiub berhampiran api yang lebih ringan (api).
5.- Masukkan pemegang inokulasi ke dalam tiub yang mengandungi budaya bakteria dan ambil sampel.
6.- Sekiranya tanaman dalam cecair, letakkan sampel yang diambil dengan pemegang di tengah slaid dan lanjutkan dengan teliti dalam bulatan kira -kira 2 cm diameter.
7.- Mensterilkan pemegang inokulasi.
8.- Benarkan pengeringan smear di udara.
9.- Ulangi langkah dari 3 hingga 8 tiga kali.
10.- Sekiranya tanaman pepejal, setitik air suling mesti diletakkan sebelum ini di slaid. Ini dilakukan untuk mencampurkan sampel kecil tanaman yang diambil dengan pemegang inokulasi, menurut petunjuk langkah 2 hingga 5 (keadaan ASEPSIS).
Ia boleh melayani anda: Biologi Pembangunan: Sejarah, Kajian, Aplikasi Apasebelas.- Panjangkan sampel yang dicairkan dengan setitik air pada slaid dan ulangi tiga kali.
B. Penetapan
1.- Tambahkan ke guru -guru smear kering dalam medium cecair -dua tetes metanol atau etanol mutlak.
2.- Benarkan udara mengeringkan jauh dari yang lebih ringan.
3.- Sekiranya smear berasal dari budaya pepejal, tetap bau kering dibuat dengan panas, lulus 2 hingga 3 kali cepat.
4.- Sentuh bahagian bawah smear dengan bahagian punggung tangan kiri (untuk yang kanan -tangan; jika tidak, gunakan tangan kanan) dan sahkan bahawa ia adalah sejuk.
C. Pewarnaan mudah
1.- Tambahkan ke titisan smear 2 pewarna yang dipilih dan biarkan bertindak untuk masa yang diperlukan dalam protokol tertentu setiap pewarna (biasanya antara 1 dan 5 minit).
2.- Sesetengah pewarna memerlukan penggunaan haba untuk pengaktifan, di mana anda perlu berhati -hati apabila memanaskan bagasi dalam api yang lebih ringan (memanipulasi dengan pinset dan mengelakkan mendidih). Terlalu panas dari smear boleh memusnahkan sel -sel yang dikehendaki.
3.- Keluarkan pencucian pewarna yang berlebihan dengan air suling dari gambar. Hilangkan air basuh, perlahan -lahan memukul slaid untuk lagunya, cenderung di meja kerja.
4.- Benarkan pengeringan udara.
5.- Bergantung pada jenis pemerhatian, penutup digunakan atau tidak pada tahap ini. Penutup dan mengekalkan smear. Sekiranya pemerhatian menyelam minyak dijalankan pada tahap ini, smear tidak digunakan tetapi smear tidak dapat dipelihara.
D. Pemeliharaan muktamad smear
1.- Tenggelamkan smear berturut -turut dalam setiap penyelesaian yang ditunjukkan di bawah, sekurang -kurangnya 5 minit. Tujuan "bilik mandi" ini adalah untuk meninggalkan smear sepenuhnya dehidrasi. Setiap reagen mesti dikeringkan dengan baik, sebelum memasuki smear di bilik mandi berikut.
Perintah mandi dehidrasi adalah seperti berikut:
- 70 % etanol
- 95 % etanol
- Aseton tulen
- Campuran aseton -xilol 1: 1
- Xilol
Kemudian biarkan pengeringan udara.
2.- Pasang penutup, sebaiknya 22 × 22 mm, menggunakan balsem Kanada atau cara lain untuk pemasangan.
Rujukan
- Cappucino, j.G. dan Welch, c.T. (2017). Mikrobiologi: Makmal Manual. Pearson.
- Holt, j.G. Editor. (1977). Manual bakteriologi penentu Bergey yang lebih pendek. 8th Baltimore: The Williams dan Wilkins Co.

