Asid hypoyodoso (HIO)
- 1497
- 61
- Ismael Turner
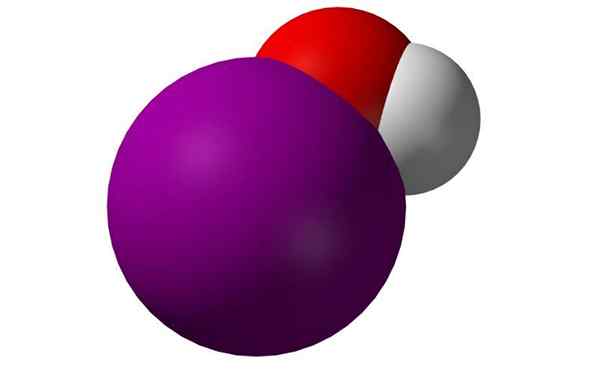
 Molekul asid hypoyodose. Sumber: Benjah-bmm27, Wikimedia Commons
Molekul asid hypoyodose. Sumber: Benjah-bmm27, Wikimedia Commons Apakah asid hypoyodose?
Dia asid hypoyodose, Juga dikenali sebagai monoxoyodate (i) hidrogen atau yodol, ia adalah sebatian bukan organik formula HIO. Ia adalah oxacid iodin, dengan atom oksigen, salah satu hidrogen dan salah satu iodin dengan keadaan pengoksidaan 1+.
Kompaunnya sangat tidak stabil, kerana ia cenderung mengalami tindak balas decimasi di mana ia dikurangkan kepada iodin molekul dan mengoksidakan asid iodosa mengikut reaksi: 5hio → 2i2 + Hio3 + 2h2Sama ada.
Kompaun adalah asid paling lemah oksasid halogen dengan keadaan pengoksidaan 1+. Garam asid ini dikenali sebagai hypoyoditos.
Garam ini lebih stabil daripada asid dan dibentuk dengan cara yang sama daripada rakan -rakan klorin dan bromin mereka, bertindak balas yodium molekul dengan alkali atau alkali logam hidroksida.
Asid hypoyodoso dihasilkan dengan bertindak balas dengan iodin molekul dengan merkuri oksida (II), menurut reaksi:
2i2 + 3hgo + h₂o → 2hio + HGI2 ● 2HGO
Jejak kompaun juga diperolehi dengan bertindak balas dengan iodin molekul dengan kalium hidroksida untuk membentuk, pada mulanya, kalium iodida dan kalium hypoyodite mengikut reaksi:
Yo2 + 2koh → ki + kio
Walau bagaimanapun, asid hypoyodous, sebagai asid yang lemah, menjadikan hidrolisis hypoyodite kalium, kecuali terdapat kelebihan kalium hidroksida.
Kio + h₂o → hio + koh
Ia juga boleh diperoleh, seperti rakan klorin dan brominnya, menjadikan yodin molekul dengan reaksi air.
Walau bagaimanapun, memandangkan keseimbangan keseimbangan yang berterusan, yang berada dalam urutan 10-13, Jumlah yang diperoleh sangat kecil.
Ia boleh melayani anda: Berapa banyak elektron custain yang dimiliki oleh karbon?Sifat fizikal dan kimia
- Asid hypoyodose hanya wujud sebagai larutan akueus, yang kekuningan. Sebatian keadaan pepejal tidak dapat mengasingkan, jadi kebanyakan sifatnya secara teorinya diperolehi oleh pengiraan pengiraan.
- Asid hypoyodose mempunyai berat molekul 143,911 g/mol, titik lebur 219.81 ° C, titik mendidih 544.27 ° C dan tekanan wap 6.73 x 10-14 Milimeter Mercury.
- Molekulnya sangat larut dalam air, dapat membubarkan antara 5.35 x 105 dan 8.54 x 105 Gram terdiri daripada satu liter pelarut ini.
- Hio adalah oksidan yang kuat dan boleh membentuk campuran letupan.
- Dia juga merupakan ejen pengurangan, dapat mengoksidakan bentuk asid iodik, yodium dan berasid. Dalam penyelesaian berair, menjadi asid lemah, ia sebahagiannya dipisahkan dalam ion hypoyodite (OI-) dan h+.
- Hio bertindak balas dengan pangkalan untuk membentuk garam yang dipanggil hypoyoditos. Sebagai contoh, natrium hypoyodite (NaOI) dibentuk dengan bertindak balas asid hipoyod dengan natrium hidroksida.
HOI + NaOH → Naoi + H₂o
- Asid hypoyodoso juga bertindak balas dengan mudah dengan pelbagai molekul organik dan biomolekul.
Kereaktifan dan bahaya
Asid hypoyodose adalah kompaun yang tidak stabil yang menguraikan yodium asas. Iodin adalah sebatian toksik yang mesti ditangani dengan teliti.
Asid hypoyodose berbahaya sekiranya hubungan kulit dan mata (menjengkelkan) dan dalam kes pengambilan dan penyedutan.
Sekiranya hubungan mata, anda harus mengesahkan sama ada kanta sentuh digunakan dan mengeluarkannya dengan segera. Mata harus dibilas dengan air mengalir selama sekurang -kurangnya 15 minit, menjaga kelopak mata terbuka. Air sejuk boleh digunakan. Tidak ada lembaran mata yang harus digunakan.
Boleh melayani anda: vanadium: sejarah, sifat, struktur, kegunaanSekiranya bahan kimia bersentuhan dengan pakaian, simpannya secepat mungkin, melindungi tangan dan badannya sendiri. Letakkan mangsa di bawah mandi keselamatan.
Sekiranya bahan kimia berkumpul di kulit yang terdedah kepada mangsa, seperti tangan, kulit yang tercemar dengan air yang mengalir dan sabun yang tidak abrasive dibasuh dengan lembut dan berhati -hati. Air sejuk boleh digunakan. Sekiranya kerengsaan berterusan, dapatkan perhatian perubatan. Basuh pakaian yang tercemar sebelum menggunakannya lagi.
Sekiranya sentuhan kulit serius, ia harus dibasuh dengan sabun disinfektan dan menutup kulit yang tercemar dengan krim antibakteria.
Sekiranya penyedutan, mangsa harus dibenarkan berdiri di kawasan pengudaraan yang baik. Sekiranya penyedutan itu serius, mangsa mesti dipindahkan ke kawasan yang selamat secepat mungkin. Keluarkan pakaian yang ketat, seperti leher baju, tali pinggang atau tali leher.
Sekiranya mangsa sukar bernafas, oksigen mesti diberikan. Sekiranya mangsa tidak bernafas, resusitasi mulut dibuat. Sentiasa mengambil kira bahawa ia boleh berbahaya bagi orang yang memberikan bantuan untuk memberi mulut ke mulut ke mulut apabila bahan yang disedut adalah toksik, berjangkit atau mengakis.
Sekiranya berlaku pengambilan, ia tidak mendorong muntah. Dalam semua kes, perhatian perubatan segera harus dicari.
Aplikasi
- Asid hypoyodose digunakan sebagai ejen pengoksidaan yang kuat dan sebagai ejen pengurangan dalam tindak balas makmal.
- Ia digunakan untuk menghasilkan sebatian kimia yang dikenali sebagai hypoyodites.
- Kaedah spektrofotometrik juga digunakan untuk mengukur pembentukan asid hipoyod untuk memantau tindak balas di mana iodin terlibat.
Boleh melayani anda: reaksi anjakanHaluros dimasukkan ke dalam aerosol, di mana mereka memulakan pemusnahan pemangkin ozon (atau3) Mengenai lautan dan menjejaskan troposfera global. Dua masalah alam sekitar yang menarik yang menjalani siasatan berterusan adalah: memahami bagaimana halogen molekul dalam fasa gas reaktif dihasilkan secara langsung dari halida tak organik yang terdedah kepada atau3 dan menyekat faktor persekitaran yang mengawal proses interfacial ini.
Rujukan
- Asid hypoiodous. Pulih dari EBI.Ac.UK.
- Pusat Kebangsaan Maklumat Bioteknologi. Pulih dari pubchem.

