Asid Selenhydric (H2SE) Apakah, Struktur, Hartanah, Kegunaan
- 5050
- 1595
- Anthony Breitenberg
 Hidrogen seleniuro: dua molekul hidrogen dan satu selenium
Hidrogen seleniuro: dua molekul hidrogen dan satu selenium Apa itu asid selenhydric?
Dia Asid Selenhydric o Hydrogen Seleniuro adalah sebatian bukan organik yang formula kimia adalah h2Dia. Ia adalah sifat kovalen, dan dalam keadaan suhu dan tekanan biasa ia adalah gas tanpa warna; Tetapi dengan bau yang kuat dari kehadirannya yang kecil. Secara kimia, ia adalah saluran, jadi selenium mempunyai valencia -2 (i2-).
Dari semua seleniuros, h2Ia adalah yang paling toksik kerana molekulnya kecil dan atom seleniumnya mempunyai halangan yang kurang sterik ketika bertindak balas. Sebaliknya, bau itu membolehkan mereka yang bekerja dengannya untuk mengesannya dalam perbuatan itu sekiranya di luar loceng makmal.
Hidrogen seleniuro boleh disintesis dengan gabungan langsung dua elemennya: hidrogen molekul, h2, dan selenium logam. Ia juga boleh didapati dengan membubarkan sebatian yang kaya dengan selenium, seperti seleniuro besi (II), fese, dalam asid hidroklorik.
Sebaliknya, asid selenhydric disediakan dengan membubarkan seleniuro hidrogen di dalam air; Iaitu, yang pertama dibubarkan di dalam air, sementara yang kedua terdiri daripada minuman ringan.
Penggunaan utamanya adalah menjadi sumber selenium dalam sintesis organik dan bukan organik.
Struktur seleniuro hidrogen
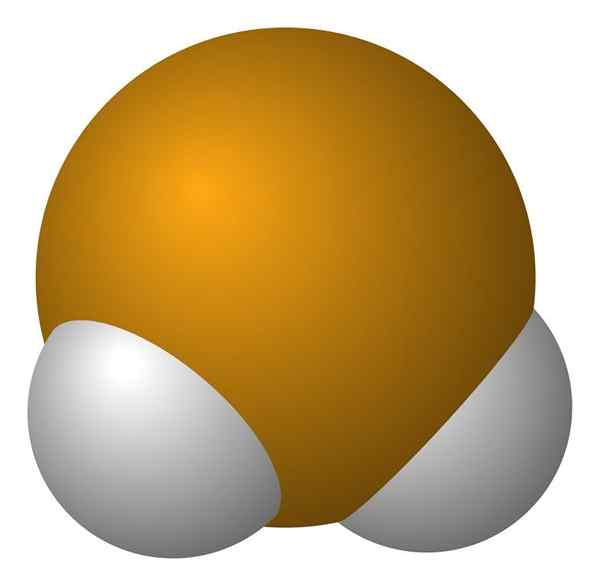
 Hidrogen seleniuro molekul. Wikimedia Commons.
Hidrogen seleniuro molekul. Wikimedia Commons. H molecula2Ia adalah geometri sudut, walaupun sudut 91 ° menjadikannya kelihatan lebih seperti L daripada v v. Dalam model sfera dan bar, atom hidrogen dan selenium adalah sfera putih dan kuning, masing -masing.
Molekul ini, seperti yang ditunjukkan, adalah yang berada dalam fasa gas; iaitu, untuk seleniuro hidrogen. Semasa melarutkan air, ia mengeluarkan proton dan dalam penyelesaian anda mempunyai pasangan HSE- H3Sama ada+; Tork ion ini datang ke asid selenhydric, dilambangkan sebagai h2Se (ac) untuk membezakannya dari hidrogen seleniuro, h2Se (g).
Boleh melayani anda: metilena biru: ciri, penyediaan, kegunaan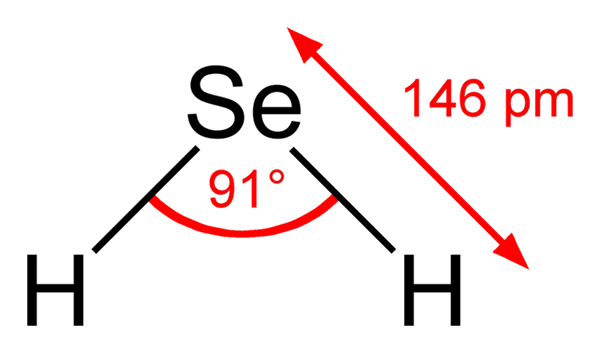 Formula struktur asid seleenhydric. Ben Mills, Wikimedia Commons ..
Formula struktur asid seleenhydric. Ben Mills, Wikimedia Commons .. Oleh itu, struktur antara h2Se (ac) dan h2SE (g) sangat berbeza; Yang pertama dikelilingi oleh sfera berair dan mempunyai beban ionik, dan yang kedua terdiri daripada aglomerat molekul fasa gas.
Molekul H2Mereka hampir tidak dapat berinteraksi antara satu sama lain melalui kuasa yang sangat lemah dipolo-dipolo. Selenium, walaupun ia kurang elektronegatif daripada sulfur menumpukan ketumpatan elektronik yang lebih besar untuk "merebutnya" dari atom hidrogen.
Selenio hydrues dimampatkan
Jika h molekul2Mereka menjalani tekanan yang luar biasa (beratus-ratus IPK), secara teorinya dipaksa untuk menguatkan dengan membentuk pautan SE-H-SE; Ini adalah pautan dari tiga pusat dan dua elektron (3c-2e) di mana hidrogen mengambil bahagian. Oleh itu, molekul mula membentuk struktur polimer yang menentukan pepejal.
Di bawah syarat -syarat ini, pepejal dengan lebih banyak hidrogen dapat diperkaya, yang sepenuhnya mengubah struktur yang dihasilkan. Di samping itu, komposisi menjadi jenis HnSe, di mana n berbeza dari 3 hingga 6. Oleh itu, selenium hidrida dimampatkan oleh tekanan ini, dan dengan kehadiran hidrogen, mempunyai formula kimia h3Saya tahu h6Dia.
Dianggarkan bahawa hidror selenium ini diperkaya dengan hidrogen mempunyai sifat superkonduktif.
Sifat
Penampilan fizikal
Gas tidak berwarna yang pada suhu rendah berbau seperti putrefacto dan telur busuk jika kepekatannya meningkat. Bau itu lebih teruk dan lebih sengit daripada sulfida hidrogen (yang sudah cukup tidak menyenangkan). Walau bagaimanapun, ini bagus, kerana ia membantu pengesanan mudah dan mengurangkan risiko hubungan atau penyedutan yang berpanjangan.
Apabila ia terbakar, ia mengeluarkan produk api kebakaran interaksi elektronik dalam atom selenium.
Boleh melayani anda: Sulfur oksidaJisim molekul
80.98 g/mol.
Takat didih
-41 ° C.
Takat lebur
-66 ° C.
Tekanan wap
9.5 atm pada suhu 21 ° C.
Ketumpatan
3,553 g/l.
Pkke
3.89.
Kelarutan air
0.70 g/100 ml. Ini menyokong fakta bahawa atom selenium h2Anda tidak dapat membentuk jambatan hidrogen yang cukup besar dengan molekul air.
Kelarutan dalam pelarut lain
-Larut dalam cs2, yang tidak menghairankan oleh analogi kimia antara selenium dan sulfur.
-Larut Phosgen (pada suhu rendah, kerana ia mendidih pada suhu 8 ° C).
Nomenclature
Seperti yang dijelaskan dalam bahagian sebelumnya, nama kompaun ini berbeza -beza bergantung kepada sama ada h2Ia berada dalam soda atau fasa terlarut di dalam air. Ketika ada di dalam air, ada ceramah asid seleenhydric, yang tidak lebih dari sekadar hidrasi dalam istilah bukan organik. Tidak seperti molekul gas, watak berasidnya lebih besar.
Walau bagaimanapun, sama ada gas atau dibubarkan di dalam air, atom selenium mengekalkan ciri -ciri elektronik yang sama; Contohnya, Valencia adalah -2, melainkan jika anda mengalami reaksi pengoksidaan. Valencia ini -2 adalah sebab mengapa ia dipanggil seleniAurochs hidrogen, kerana anion seleniuro adalah2-; yang lebih reaktif dan pengurangan daripada s2-, sulfida.
Sekiranya tatanama sistematik digunakan, bilangan atom hidrogen dalam sebatian mesti ditentukan. Oleh itu, h2Ia dipanggil: seleniuro dari memberiHidrogen.
Seleniuro atau hidrida?
Beberapa sumber merujuknya sebagai hidrida. Sekiranya sebenarnya, selenium akan mempunyai caj positif +2, dan beban negatif hidrogen -1: SEH2 (Dia2+, H-). Selenium adalah atom elektronegatif yang lebih banyak daripada hidrogen, dan oleh itu berakhir "memonopoli" ketumpatan elektronik tertinggi dalam molekul H2Dia.
Boleh melayani anda: termokimiaWalau bagaimanapun, oleh itu, kewujudan selenium hydride tidak dapat dibuang. Malah, dengan kehadiran h anion- Ia akan memudahkan pautan SE-H-SE, yang bertanggungjawab untuk struktur pepejal yang dibentuk dengan tekanan besar mengikut kajian komputer.
Aplikasi
Metabolik
Walaupun nampaknya bercanggah, walaupun ketoksikan besar h2Se, ia dihasilkan di dalam badan di laluan metabolik selenium. Walau bagaimanapun, sel -sel hampir tidak dihasilkan sebagai perantara dalam sintetik selenioprotein, atau akhirnya menjadi metilasi dan dikeluarkan; Salah satu gejala ini adalah rasa bawang putih di mulut.
Industrialis
H2Ia digunakan terutamanya untuk menambah atom selenium kepada struktur pepejal, seperti bahan semikonduktor; kepada molekul organik, seperti alkena dan nitril untuk sintesis seleniuros organik; atau penyelesaian untuk mendakan seleniuros logam.
Rujukan
- Hidrogen selenide. Diperoleh dari: dalam.Wikipedia.org
- Hidrogen selenide, h2Dia. Pulih dari: selenium.Atomistry.com

