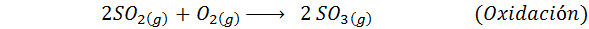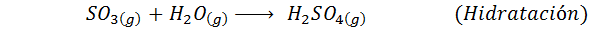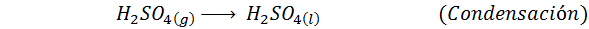Asid sulfurik (H2SO4)

- 789
- 92
- Anthony Breitenberg
Kami menerangkan apa asid sulfurik, struktur kimianya, sifat, bagaimana ia diperoleh, aplikasi dan risiko penggunaan adalah
 Bot asid sulfurik (H2SO4)
Bot asid sulfurik (H2SO4) Apakah asid sulfurik?
Dia asid sulfurik, Juga dipanggil hidrogen sulfat dan minyak vitriol, ia adalah asid sulfur oxacid yang dibentuk oleh tindak balas anhidrid sulfurik (begitu juga3) dan air. Formula molekulnya ialah h2SW4 Dan ia, setakat ini, asid mineral yang paling dihasilkan dan digunakan.
Ia adalah asid mineral yang kuat dan sangat menghakis yang boleh didapati dengan air sehingga dapat disediakan dalam bentuk penyelesaian hampir semua kepekatan antara 0 dan sekitar 18 molar.
Jumlah pengeluaran dan penggunaan sebatian ini adalah disebabkan oleh pelbagai aplikasi dalam industri yang bervariasi sebagai pertanian, industri petrokimia, dalam sintesis organik dan bukan organik dan dalam rawatan air kumbahan, untuk menamakan beberapa hanya beberapa hanya beberapa hanya beberapa.
Struktur asid sulfurik
Asid sulfurik dibentuk oleh atom sulfur pusat dengan Valencia VI yang dikelilingi oleh 4 atom oksigen, dua daripadanya dikaitkan dengan atom hidrogen. Struktur Lewis dibentangkan di bawah:
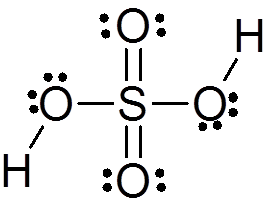
Seperti yang anda lihat, sulfur dalam sebatian ini dikelilingi oleh 12 elektron (6 pasang), jadi ia mewakili salah satu pengecualian peraturan oktet.
Dikelilingi oleh 4 atom, teori penolakan pasangan elektron Valencia (Trepev) meramalkan bahawa sebatian ini mesti menganggap geometri tetrahedral kira -kira, yang ditunjukkan dalam imej berikut:
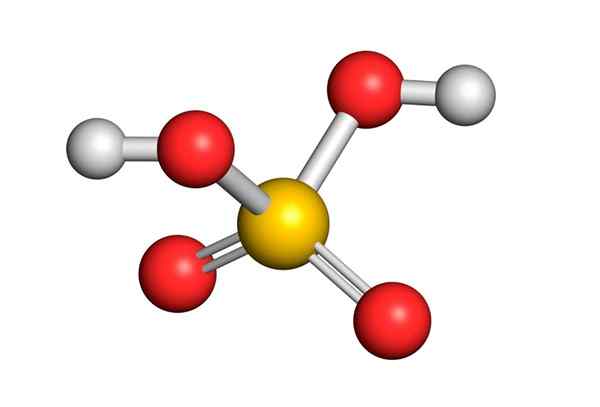
Oleh kerana elektronegativiti oksigen yang tinggi dan struktur resonans yang berbeza yang boleh dimiliki oleh asid sulfurik, ikatan antara oksigen dan hidrogen sangat terpolarisasi, yang menjadikannya sangat berasid dan mudah untuk memisahkan hidrogen.
Sifat asid sulfurik
Akibat strukturnya, asid sulfurik mempunyai sifat fizikal dan kimia berikut:
Ia boleh melayani anda: epoksida: tatanama, mendapatkan, aplikasi, contohCiri-ciri fizikal
- Asid sulfurik tulen adalah cecair tanpa warna dan tandas yang mempunyai ketumpatan 1,8302 g/ml.
- Titik leburnya adalah 10.31 ° C dan mendidih adalah 337 ° C, walaupun pada suhu itu ia cenderung untuk mengurai untuk menghasilkan air dan sulfurik anhydride (juga disebut sulfur trioksida).
- Ia benar -benar lobak dengan air, jadi anda boleh menyediakan penyelesaian dengan sebarang tumpuan. Walau bagaimanapun, penyelesaian dengan lebih daripada 98.3% dalam jisim asid ini tidak stabil dan asid terurai sehingga kepekatannya berkurang hingga 98.3%. Penyelesaian ini stabil dan apa yang dikenali sebagai asid sulfurik pekat.
- Dalam keadaan murni atau pekat, ia adalah cecair yang lebih likat daripada air.
Sifat kimia
- Asid sulfurik tulen adalah bahan oksidan yang kuat dan menghakis. Ia mempunyai keupayaan untuk mengoksidakan, dehidrat dan sulfonar ke pelbagai sebatian organik dan berkarbonat yang lain.
- Ia adalah asid diprotik yang kuat yang benar -benar kehilangan proton pertamanya dengan melarutkan air sehingga menjadi asas konjugasi, ion bisulfat (HSO4-). Ion ini juga asid, walaupun lebih lemah daripada asid asal.
- Penyelesaian asid sulfurik berair sangat berasid dan dapat membubarkan banyak logam, menghasilkan hidrogen gas. Mereka juga dapat meneutralkan pangkalan yang kuat sepenuhnya.
- Bertindak balas dengan banyak alkohol dan air, melepaskan sejumlah besar haba dalam proses.
Bagaimana asid sulfurik diperolehi?
Tiga proses pengeluaran asid sulfurik yang paling terkenal adalah: proses hubungan, proses asid sulfurik basah dan proses kamera plumbum.
1. Sintesis asid sulfurik dengan proses hubungan
Ini adalah kaedah yang paling banyak digunakan hari ini untuk menghasilkan asid sulfurik. Proses ini terdiri daripada 5 langkah di mana sulfur asas menjadi sulfur dioksida (begitu2), maka sulfur trioksida (begitu3), asid disulfurik (h2S2Sama ada7) dan, akhirnya, dalam asid sulfurik. Reaksi yang terlibat adalah:
Dapat melayani anda: apakah rombus keselamatan dan apa itu?
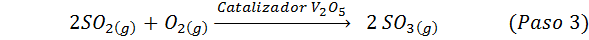


Langkah kedua proses hanya terdiri daripada pemurnian sulfur dioksida sebelum ditukar kepada sulfur atau sulfurik anhidrida trioksida. Reaksi langkah ketiga berlaku apabila sulfur dioksida gas bersentuhan dengan pemangkin vanadium pentaoxide pepejal (v2Sama ada5), Dan itulah sebabnya kaedah itu dipanggil proses hubungan.
2. Sintesis asid sulfurik dengan proses basah
Proses ini direka untuk membersihkan gas pelepasan pelbagai jenis industri dan tumbuhan kimia. Hasil sampingan pembersihan ini adalah asid sulfurik gred komersial selain wap air panas, yang boleh digunakan semula dalam proses perindustrian asal.
Dalam hal proses basah, reaksi kebanyakannya. Reaksi penting yang berlaku pada setiap peringkat adalah:
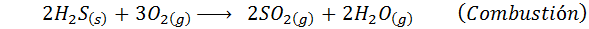
3. Sintesis asid sulfurik dengan proses kamera plumbum
Ini adalah kaedah kuno untuk menghasilkan asid sulfurik yang digunakan hari ini sangat sedikit. Prosesnya adalah untuk membakar sulfur asas dengan kehadiran oksigen udara di ruang kayu berlapis plumbum, dan oleh itu namanya.
Selepas pembakaran ini, sulfur dioksida kemudian bertindak balas dengan oksida nitrogen yang dihasilkan oleh penguraian natrium nitrat atau dengan cara lain. Akhirnya, selepas satu siri tindak balas tambahan, asid sulfurik diperolehi.
Boleh melayani anda: kelalang latar belakang rataAplikasi biasa
- Aplikasi utama asid sulfurik adalah sebagai sumber sulfur dalam bentuk sulfat dalam pembuatan baja. Malah, kira -kira 60% asid sulfurik yang dihasilkan di dunia dimaksudkan untuk tujuan ini.
- Dalam industri kimia ia digunakan untuk sintesis detergen, pigmen, pemangkin untuk industri petrokimia dan dalam pemprosesan mineral untuk mendapatkan logam yang berbeza.
- Akhirnya, asid sulfurik adalah elektrolit yang digunakan dalam bateri plumbum yang digunakan di kebanyakan kereta.
Risiko yang berkaitan dengan asid sulfurik
Oleh kerana sifat kimianya, asid sulfurik boleh menjadi sangat berbahaya bagi kedua -dua manusia dan haiwan dan alam sekitar secara umum. Ini adalah beberapa risiko yang berkaitan dengan bahan kimia ini:
- Ciri -ciri yang menghakis dan dehidrasi menjadikan asid tulen menyebabkan kerosakan yang besar jika ia bersentuhan dengan kulit.
- Sebaliknya, reaksi larutan akueus asid sulfurik dengan logam menghasilkan hidrogen gas, yang merupakan bahan bahan bakar dan bahan letupan.
- Asid sulfurik sendiri tidak mengalami tindak balas pembakaran, tetapi, sebagai oksidan yang kuat, merangsang pembakaran bahan -bahan lain, bertindak sebagai sejenis pemangkin, jadi ia mewakili risiko kebakaran yang besar.
- Di samping.
Atas sebab -sebab ini dan banyak lagi, asid sulfurik adalah bahan yang harus ditangani dengan teliti.