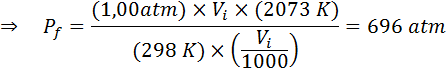Undang -undang Gas Am

- 3447
- 21
- Kerry Schmitt
Apakah undang -undang gas umum?
The Undang -undang Gas Am, Kadang-kadang juga dipanggil undang-undang gabungan gas, ia adalah gabungan undang-undang Boyle, Charles dan gay-lussac. Ini adalah undang -undang yang menggambarkan hubungan antara tekanan, suhu dan jumlah jumlah tetap gas yang ideal.
Kenyataan undang -undang ini mengatakan:
"Sekiranya bilangan tahi lalat gas tetap, hubungan antara tekanan tekanan dan produk suhu tetap tetap."
Dalam bentuk matematik, undang -undang umum gas dinyatakan seperti berikut:
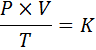
Di mana p mewakili tekanan gas, v kelantangannya, suhu mutlaknya, dan k adalah pemalar yang berkadar, yang nilainya bergantung kepada kedua -dua jumlah gas sekarang dan unit di mana pembolehubah lain dinyatakan.
Bentuk alternatif undang -undang gas umum
Sebagai undang -undang berkadar
Cara alternatif untuk menyatakan undang -undang umum gas adalah dalam bentuk undang -undang yang berkadar:
"Untuk apa -apa jumlah gas tetap, produk tekanannya dan jumlahnya berkadar terus dengan suhu".
Ini bermaksud:
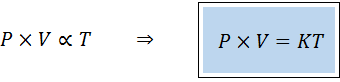
Ini bersamaan dengan mengalikan kedua -dua anggota persamaan pertama mengikut suhu.
Hubungan antara keadaan awal dan akhir
Seperti undang-undang Boyle, Charles dan Gay-Lussac, undang-undang gas umum boleh dinyatakan sebagai hubungan antara keadaan awal dan keadaan terakhir gas yang mengalami perubahan keadaan.
Tidak seperti undang -undang sebelumnya, tidak perlu bahawa tidak ada tiga pembolehubah yang tetap malar, hanya bilangan tahi lalat. Iaitu nisbah pxv/t akan sama dalam keadaan awal, Yo, Dan dalam keadaan akhir, F. Dalam erti kata lain, undang -undang gas umum juga boleh dinyatakan secara matematik sebagai:
Ia dapat melayani anda: asid píchric: apakah, struktur, sintesis, sifat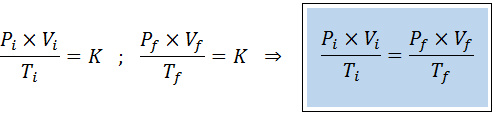
Derivasi formula undang -undang gas umum
Seperti yang disebutkan di atas, undang-undang gas umum berasal dari gabungan undang-undang Boyle, Charles dan Gay-Lussac. Undang -undang ini dibentangkan di bawah:
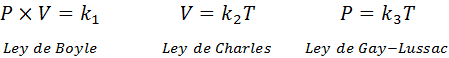
Sekiranya dari setiap undang -undang ini kita membersihkan pemalar k, Dan kemudian kami melipatgandakan mereka antara satu sama lain, kami mendapat:
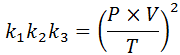
Sekarang, mengambil akar kuadrat di kedua -dua ahli, undang -undang gas am diperolehi:
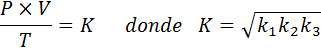
Undang -undang Umum Gas vs. Undang -undang gas ideal
Undang -undang Gas Am dengan Undang -undang Gas Ideal tidak boleh dikelirukan. Walaupun dua undang-undang yang sangat serupa dan juga berkaitan dengan undang-undang, undang-undang gas umum menggabungkan undang-undang Boyle, Charles dan Gay-Lussac.
Bagi pihaknya, undang -undang gas ideal menambah prinsip Avogadro, mengikut yang "Jumlah yang sama gas yang berbeza diukur di bawah keadaan suhu dan tekanan yang sama, mengandungi bilangan zarah yang sama ".
Akibatnya, sebagai tambahan kepada suhu, kelantangan dan tekanan, undang -undang gas ideal juga membolehkan pembolehubah ini berkaitan dengan bilangan zarah atau tahi lalat gas, jadi ia mewakili persamaan keadaan status status Gas yang ideal.
Dalam persamaan berikut, perbezaan antara kedua -dua undang -undang ini dapat diperhatikan dengan lebih mudah:

Perhatikan bahawa perbezaan utama antara kedua -dua undang -undang adalah bahawa undang -undang gas yang ideal termasuk n, yang mewakili bilangan tahi lalat, dan juga malar K, mempunyai R malar yang berterusan dari gas ideal.
Boleh melayani anda: terpenosKita boleh mengatakan bahawa undang -undang gas ideal lebih umum daripada undang -undang gas umum, kerana ia boleh digunakan untuk sebarang jumlah gas di bawah sebarang set tekanan, suhu dan kelantangan keadaan. Sebaliknya, permohonan undang -undang gas umum menghendaki jumlah gas tetap malar.
Contoh permohonan undang -undang gas umum
Berikut adalah beberapa contoh masalah biasa di mana undang -undang gas umum boleh digunakan:
Contoh 1: Gelembung udara bawah air
Katakan bahawa penyelam yang berada pada kedalaman 20 m di bawah air di mana tekanan adalah 3.00 atm dan suhu adalah 15 ° C melepaskan nafas udara dan salah satu gelembung mempunyai jumlah awal 100 cm3.
Tentukan jumlah gelembung udara apabila mencapai permukaan yang berada dalam keadaan suhu dan tekanan standard, dengan mengandaikan bahawa jumlah udara di dalam gelembung tidak berubah apabila ia meningkat.
Penyelesaian
Pertama, kita mesti mengeluarkan semua data dari pernyataan. Difahamkan terdapat dua negeri yang berbeza untuk gas, satu awal dan satu hujung, jadi kami memisahkan data menjadi dua kumpulan. Ia juga perlu menukar suhu pada suhu mutlak:

Oleh kerana masalah itu menyatakan bahawa tidak ada perubahan dalam jumlah gas (udara) maka kita boleh memohon undang -undang gas umum, dari mana kita dapat membersihkan jumlah akhir:
Boleh melayani anda: rodio: sejarah, sifat, struktur, kegunaan, risiko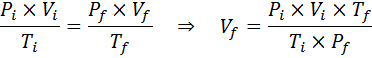
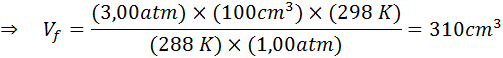
Oleh itu, gelembung udara mencapai jumlah 310 cm3 Apabila sampai ke permukaan.
Contoh 2: Tekanan Tinggi
Berapa banyak tekanan gas ideal yang berada pada suhu ambien 25 ° C dan tekanan 1.00 atm dan memampatkan seribu jumlahnya pada masa yang sama panas hingga 1800 ° C dalam bekas tertutup?
Penyelesaian
Seperti dahulu, kita mulakan dengan mengekstrak data:

Seperti yang dikatakan bahawa proses itu dijalankan dalam bekas yang dimeteraikan, maka jumlah gas tidak berubah, jadi undang -undang gas umum boleh digunakan: