Asid tartarik
- 822
- 193
- Dallas Bernhard
Kami menerangkan apakah asid tartarik, sifat fizikal dan kimianya, struktur dan aplikasinya
Apakah asid tartarik?
Dia asid tartarik Ia adalah sebatian organik yang formula molekulnya adalah COOH (Choh)2COOH. Ia mempunyai dua kumpulan karboksil; Iaitu, anda boleh melepaskan dua proton (h+). Dengan kata lain, ia adalah asid diprotik. Ia juga boleh diklasifikasikan sebagai asid aldaric (gula asid) dan derivatif asid succinic.
Garamnya dikenali sejak zaman dahulu lagi dan merupakan salah satu produk sekunder penghuraian wain. Ia dikristalisasi sebagai sedimen putih yang dibaptiskan sebagai "berlian wain", yang terkumpul di gabus atau di bahagian bawah tong dan botol. Garam ini adalah kalium biitartrate (atau tartrato asid kalium).
Garam asid tartarik mempunyai persamaan kehadiran satu atau dua kation (NA+, K+. NH4+, Ac2+, dan lain-lain.) kerana, dengan melepaskan dua protonnya, ia tetap dikenakan secara negatif dengan beban -1 (seperti garam biterrato) atau -2.
Sebaliknya, kompaun ini telah menjadi subjek kajian dan pengajaran teori organik yang berkaitan dengan aktiviti optik, lebih tepatnya dengan stereokimia.
Di mana asid tartarik?
Asid Tartarik adalah komponen banyak tumbuhan dan makanan, seperti aprikot, alpukat, epal, tamarindos, biji bunga matahari dan anggur.
Dalam proses penuaan wain asid ini - suhu sejuk - digabungkan dengan kalium untuk mengkristal sebagai tartrato. Dalam wain merah, kepekatan tartrats ini kurang, sementara dalam wain putih mereka lebih banyak.
Tartrat adalah garam kristal putih, tetapi apabila mereka menyekat kekotoran persekitaran alkohol, mereka memperoleh nada kemerahan atau ungu.
Boleh melayani anda: reaksi anjakanStruktur asid tartarik
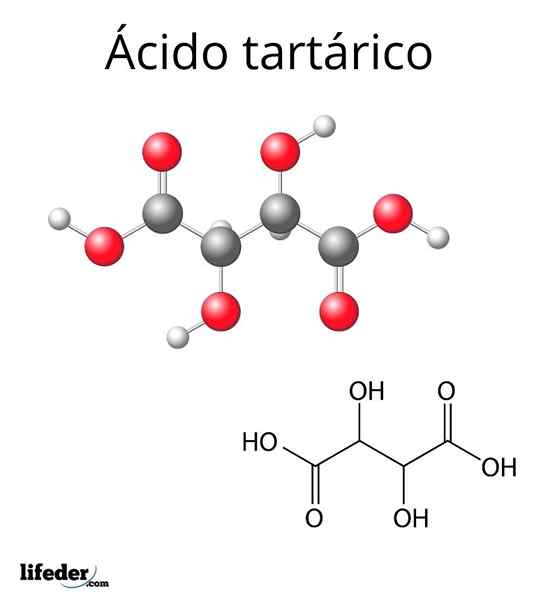
 Struktur molekul asid tartarik
Struktur molekul asid tartarik Struktur molekul asid tartarik diwakili dalam imej atas. Kumpulan karboksil (-cooh) terletak di hujung sisi dan dipisahkan oleh rantai karbon dua pendek (c2 dan c3).
Sebaliknya, setiap karbon ini dikaitkan dengan h (sfera putih) dan kumpulan OH. Struktur ini dapat memutar pautan c2-C3, dengan itu menghasilkan beberapa penyesuaian yang menstabilkan molekul.
Iaitu, pautan pusat molekul yang rosak sebagai silinder berputar, berturut -turut menggantikan pelupusan spatial kumpulan -COOH, H dan OH (unjuran Newman).
Sebagai contoh, dalam imej dua kumpulan OH menunjukkan arah yang bertentangan, yang bermaksud bahawa mereka berada dalam kedudukan anti antara satu sama lain. Perkara yang sama berlaku untuk kumpulan -cooh.
Konformasi lain yang mungkin ialah beberapa kumpulan yang terkelupas, di mana kedua -dua kumpulan berorientasikan ke arah yang sama. Konformasi ini tidak akan memainkan peranan penting dalam struktur kompaun jika semua kumpulan karbon c2 dan c3 Mereka sama.
Seperti dalam kompaun ini, empat kumpulan berbeza (-cooh, oh, h, dan sisi lain molekul), karbon adalah asimetrik (atau kiral) dan mempamerkan aktiviti optik yang terkenal.
Cara di mana kumpulan disusun dalam karbon2 dan c3 asid tartarik menentukan beberapa struktur dan sifat yang berbeza untuk sebatian yang sama; iaitu, membolehkan kewujudan stereoisomer.
Aplikasi asid tartarik
Dalam industri makanan
Ia digunakan sebagai penstabil eulsion di kedai roti. Ia juga digunakan sebagai ramuan untuk ragi, jem, gelatin dan minuman ringan. Ia juga memenuhi fungsi sebagai pengasingan, perpustakaan dan penawar ion.
Ia boleh melayani anda: natrium bromida (nabr)Asid tartarik terdapat dalam makanan ini: kue manis, gula -gula, coklat, cecair gas, produk roti dan wain.
Dalam penghuraian wain, ia digunakan untuk menjadikannya lebih seimbang, dari sudut pandang gustatory, dengan mengurangkan pH ini.
Dalam industri farmaseutikal
Ia digunakan dalam penciptaan pil, antibiotik dan pil effervescent, serta ubat -ubatan yang digunakan dalam rawatan penyakit jantung.
Dalam industri kimia
Ia digunakan dalam fotografi, serta dalam galvanoteknik dan merupakan antioksidan yang ideal untuk lemak perindustrian.
Ia juga digunakan sebagai penculik ion logam. Sebagai? Berputar pautan mereka sedemikian rupa sehingga anda dapat mencari atom oksigen kumpulan karbonil, kaya dengan elektron, di sekitar spesies yang dimuatkan secara positif.
Dalam industri pembinaan
Melambatkan proses mengeraskan plaster, simen dan plaster, menjadikan manipulasi bahan -bahan ini lebih efisien.
Sifat asid tartarik

Aplikasi asid tartarik yang paling biasa adalah:
- Asid tartarik dipasarkan dalam bentuk serbuk kristal atau kristal putih sedikit legap. Ia mempunyai rasa yang menyenangkan, dan harta ini menunjukkan wain berkualiti tinggi.
- Cair pada 206 ºC dan terbakar pada 210 ºC. Ia sangat larut dalam air, alkohol, penyelesaian asas dan boraks.
- Ketumpatannya ialah 1.79 g/ml pada 18 ºC dan membentangkan dua pemalar keasidan: PKA1 dan PKA2. Iaitu, setiap dua proton asid mempunyai kecenderungan sendiri untuk membebaskan diri dalam persekitaran berair.
- Seperti yang mempunyai kumpulan -kumpulan dan OH, ia boleh dianalisis dengan spektroskopi inframerah (IR) untuk penentuan kualitatif dan kuantitatif mereka.
- Teknik lain seperti spektroskopi massa, dan resonans magnetik nuklear, membolehkan analisis sebelumnya dari kompaun ini.
Stereokimia

Asid Tartarik adalah sebatian organik pertama yang mana resolusi enantiomerik dibangunkan. Apakah maksud ini? Ini bermaksud bahawa stereoisomernya boleh dipisahkan secara manual terima kasih kepada kerja penyelidikan biokimia Louis Pasteur, pada tahun 1848.
Dan apakah stereoisomer asid tartarik? Ini adalah: (r, r), (s, s) dan (r, s). R dan S adalah konfigurasi spatial karbon c2 dan c3.
Asid tartarik (R, R), yang paling "semulajadi", berputar cahaya terpolarisasi ke kanan; Asid tartarik (s, s) dipecahkan ke kiri, bertentangan dengan jarum jam. Dan akhirnya, asid tartarik (r, s) tidak memecahkan cahaya terpolarisasi, tidak aktif secara optik.
Louis Pasteur, dengan bantuan mikroskop dan pinset, menemukan dan memisahkan kristal asid tartarik yang menunjukkan corak "kanan" dan "kiri", seperti dalam imej unggul.
Dengan cara ini, kristal "kanan" adalah yang dibentuk oleh enantiomer (r, r), manakala kristal "kiri" adalah enantiomer (s, s).
Walau bagaimanapun, kristal asid tartarik (R, S) tidak berbeza daripada orang lain, kerana mereka mempamerkan ciri -ciri mahir dan kiri pada masa yang sama; Oleh itu, mereka tidak dapat "diselesaikan".
Rujukan
- Wikipedia. (2018). Asid tartarik. Diambil dari.Wikipedia.org
- Pubchem. (2018). Asid tartarik. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Memahami wain tartates. Pulih dari Jordanwinery.com
- Aktif. Asid tartarik. Pulih dari actipedia.org
- Pochteca. Asid tartarik. Pochteca pulih.com.mx
- Dhanesshwar Singh et al. (2012). Mengenai asal usul ketidakaktifan optik asid meso-tartaric. Jabatan Kimia, Universiti Manipur, Cancipur, Imphal, India. J. Chem. Pharm. Daging lembu., 4 (2): 1123-1129.

