Struktur, sifat asid yodhydric (HI) dan kegunaan

- 2472
- 559
- Kerry Schmitt
Dia Asid Iarhydric Ini adalah penyelesaian berair hidrogen iodida yang dicirikan oleh keasidan yang tinggi. Takrif yang lebih melekat pada istilah kimia dan IUPAC, adalah bahawa ia adalah hidrasi, yang formula kimianya adalah HI.
Walau bagaimanapun, untuk membezakannya dari molekul gas iodida hidrogen, HI (g), ia dilambangkan sebagai hi (ac). Oleh sebab itu dalam persamaan kimia, penting untuk mengenal pasti persekitaran atau fasa fizikal di mana reagen dan produk telah. Walaupun begitu, kekeliruan antara hidrogen iodida dan asid iarchloric biasanya biasa.
 Ion asid iarhydric. Sumber: Gabriel Bolívar.
Ion asid iarhydric. Sumber: Gabriel Bolívar. Sekiranya molekul yang komited diperhatikan dalam identiti mereka, perbezaan yang terkenal antara hi (g) dan hi (ac) akan dijumpai. Dalam hi (g), terdapat pautan H-I; Semasa berada di Hi (ac), mereka sebenarnya sepasang ion i- dan h3Sama ada+ berinteraksi secara elektrostal (imej unggul).
Sebaliknya, hi (ac) adalah sumber hi (g), kerana yang pertama disediakan oleh pembubaran kedua dalam air. Kerana ini, melainkan jika ia berada dalam persamaan kimia, HI juga boleh digunakan untuk merujuk kepada asid iarchydric. Hi adalah ejen pengurangan yang kuat dan sumber ion yang sangat baik i- Dalam medium berair.
[TOC]
Struktur asid yodhydric
Asid yodhydric, seperti yang dijelaskan, terdiri daripada penyelesaian hi di dalam air. Berada di dalam air, HI molekul berpecah sepenuhnya (elektrolit kuat), yang berasal dari ion i- dan h3Sama ada+. Pemisahan ini boleh diwakili dengan persamaan kimia berikut:
Hai (g) + h2Atau (l) => i-(Ac) + h3Sama ada+(Ac)
Apa yang akan bersamaan jika ditulis sebagai:
Hai (g) + h2Atau (l) => hi (ac)
Walau bagaimanapun, HI (AC) tidak mendedahkan apa yang telah berlaku kepada molekul HI gas; Ia hanya menunjukkan bahawa mereka berada dalam medium berair.
Oleh itu, struktur sebenar Hi (ac) terdiri daripada ion i- dan h3Sama ada+ Dikelilingi oleh molekul air yang melembapkannya; Semakin tertumpu asid iarhydric, semakin rendah jumlah molekul air tanpa proton.
Boleh melayani anda: Boyle LawSecara komersil, sebenarnya, kepekatan HI adalah 48 hingga 57% dalam air; Lebih pekat akan bersamaan dengan asid juga merokok (dan bahkan lebih berbahaya).
Dalam imej, dapat dilihat bahawa anion i- Ia diwakili dengan sfera ungu, dan h3Sama ada+ Dengan sfera putih dan merah, untuk atom oksigen. Kation h3Sama ada+ Mempersembahkan piramid trigonal geometri molekul (dilihat dari satah yang lebih tinggi dalam imej).
Sifat
Penerangan fizikal
Cecair tidak berwarna; Tetapi, anda boleh mempamerkan nada kekuningan dan coklat jika anda berada dalam hubungan langsung dengan oksigen. Ini kerana ion i- Mereka akhirnya mengoksidakan iodin molekul, i2. Sekiranya terdapat banyak saya2, Lebih mungkin bahawa anion triaduro akan dibentuk, i3-, yang mengotorkan penyelesaiannya sebagai coklat.
Jisim molekul
127.91 g/mol.
Bau
Ekar.
Ketumpatan
Ketumpatan adalah 1.70 g/ml untuk penyelesaian HI 57%; Oleh kerana, kepadatan berbeza -beza bergantung pada kepekatan hi yang berbeza. Kepekatan ini membentuk azeotropik (ia disuling sebagai satu bahan dan bukan sebagai campuran) yang kestabilan relatifnya berhutang pengkomersialan di atas penyelesaian lain.
Takat didih
57% hi azeotrope mendidih pada 127ºC pada tekanan 1.03 bar (lulus ke atm).
PKA
-1.78.
Keasidan
Ia adalah asid yang sangat kuat, sehingga ia menghakis untuk semua logam dan tisu; Malah untuk karet.
Ini kerana pautan H-I sangat lemah, dan mudah dipecahkan semasa pengionan airnya. Di samping itu, jambatan hidrogen i- - Hoh2+ Mereka lemah, jadi tidak ada yang mengganggu h3Sama ada+ bertindak balas dengan sebatian lain; iaitu, h3Sama ada+ mempunyai "percuma", seperti i- yang tidak terlalu menarik perhatiannya.
Boleh melayani anda: PycnometerMengurangkan ejen
Hi adalah ejen pengurangan yang kuat, yang produk reaksi utamanya adalah i2.
Nomenclature
Nomenklatur asid iarhydric berasal dari fakta bahawa iodin "berfungsi" dengan keadaan pengoksidaan tunggal: -1. Dan di samping itu, nama itu menunjukkan bahawa ia mempunyai air dalam formula strukturnya [i-] [H3Sama ada+]. Ini adalah satu -satunya namanya, kerana ia bukan sebatian murni tetapi penyelesaiannya.
Aplikasi
Sumber iodin dalam sintesis organik dan bukan organik
Hi adalah sumber ion yang sangat baik i- untuk sintesis bukan organik dan organik, dan juga ejen pengurangan yang kuat. Sebagai contoh, pembubaran berair 57% digunakan untuk sintesis alkil iodida (seperti CHO3Ch2I) dari alkohol utama. Begitu juga, kumpulan OH boleh menggantikan struktur oleh i.
Mengurangkan ejen
Asid yodhydric telah digunakan untuk mengurangkan, contohnya, karbohidrat. Jika glukosa dibubarkan dalam asid ini dipanaskan, ia akan kehilangan semua kumpulan OH, memperoleh sebagai produk hidrokarbon n-heksana.
Begitu juga, ia telah digunakan untuk mengurangkan kumpulan fungsional lembaran graphene, supaya mereka dapat berfungsi untuk peranti elektronik.
Proses CATIVA
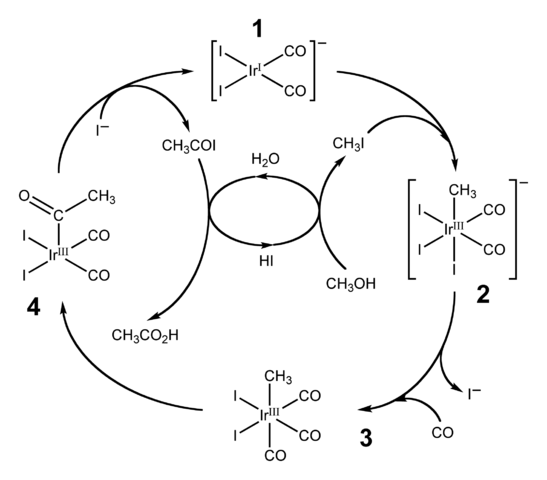 Diagram kitaran pemangkin untuk proses CATIVA. Sumber: Ben Mills [Domain Domain Awam].HI juga digunakan untuk pengeluaran perindustrian asid asetik melalui proses cativa. Ini terdiri daripada kitaran pemangkin di mana karbonilasi metanol berlaku; iaitu, kepada molekul ch3Oh kumpulan karbonil diperkenalkan, c = o, untuk berubah menjadi asid cho3COOH.
Diagram kitaran pemangkin untuk proses CATIVA. Sumber: Ben Mills [Domain Domain Awam].HI juga digunakan untuk pengeluaran perindustrian asid asetik melalui proses cativa. Ini terdiri daripada kitaran pemangkin di mana karbonilasi metanol berlaku; iaitu, kepada molekul ch3Oh kumpulan karbonil diperkenalkan, c = o, untuk berubah menjadi asid cho3COOH.
Langkah-langkah
Proses bermula (1) dengan kompleks organo-iridium [ir (co)2Yo2]-, geometri rata persegi. Kompaun ini "menerima" metil iodida, CH3Saya, produk pengasidan CHO3Oh dengan 57% hai. Air juga berlaku dalam tindak balas ini, dan terima kasih, asid asetik diperoleh pada akhirnya, sambil membenarkan hi pulih dalam langkah terakhir.
Boleh melayani anda: koloidDalam langkah ini kedua -dua kumpulan -ch3 kerana -i menyertai pusat logam ididio (2), membentuk kompleks octahedral dengan aspek yang terdiri daripada tiga ligan dan. Salah satu daripada Yodos akhirnya menggantikan dirinya dengan molekul karbon monoksida, CO; Dan sekarang (3), kompleks octahedral mempunyai aspek yang terdiri daripada tiga co -ligands.
Kemudian penyusunan semula berlaku: kumpulan -ch kumpulan3 Ia "dibebaskan" dari IR dan menyertai bersebelahan (4) untuk membentuk kumpulan asetil, -coch3. Kumpulan ini dibebaskan dari kompleks Iridido untuk menghubungkan ke ion iodida dan memberi CHO3COI, acetyl iodide. Di sini pemangkin Iridium pulih, bersedia untuk mengambil bahagian dalam kitaran pemangkin yang lain.
Akhirnya, Cho3COI mengalami penggantian i- Untuk molekul H2Atau, mekanisme yang berakhir dengan melepaskan HI dan asid asetik.
Sintesis haram
 Tindak balas pengurangan efedrine dengan fosforik merah dan fosfor kepada methaphetamine. Sumber: methamphetamine_from_ephedrine_with_hi_ru.SVG: Derived Ring0 Trabajo: MaterialScientist (Bercakap) [Domain Awam].Asid yodhydric telah digunakan untuk sintesis bahan psikotropik mengambil kesempatan daripada kuasa reduktifnya yang tinggi. Sebagai contoh, anda boleh mengurangkan ephedrine (ubat untuk rawatan asma) dengan kehadiran fosforus merah, kepada methamphetamine (imej unggul).
Tindak balas pengurangan efedrine dengan fosforik merah dan fosfor kepada methaphetamine. Sumber: methamphetamine_from_ephedrine_with_hi_ru.SVG: Derived Ring0 Trabajo: MaterialScientist (Bercakap) [Domain Awam].Asid yodhydric telah digunakan untuk sintesis bahan psikotropik mengambil kesempatan daripada kuasa reduktifnya yang tinggi. Sebagai contoh, anda boleh mengurangkan ephedrine (ubat untuk rawatan asma) dengan kehadiran fosforus merah, kepada methamphetamine (imej unggul).
Ia dapat dilihat bahawa penggantian kumpulan OH oleh i, diikuti oleh pengganti kedua untuk h.
Rujukan
- Wikipedia. (2019). Asid hidroiodik. Diperoleh dari: dalam.Wikipedia.org
- Andrews, Natalie. (24 April 2017). Penggunaan asid hidriodik. Saintifik. Pulih dari: saintifik.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Asid hidriodik. Pulih dari: alfa.com
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Asid hidriodik. Pangkalan data PUBCHEM., CID = 24841. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Steven a. Hardinger. (2017). Glosari digambarkan kimia organik: asid hidroiodik. Pulih dari: chem.UCLA.Edu
- Reusch William. (05 Mei 2013). Karbohidrat. Pulih dari: 2.Kimia.MSU.Edu
- Di Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Trapsida yang ditebang dengan grafitisasi kimia. Doi: 10.1038/NCOMMS1067.
- « Ciri -ciri pembelajaran memoris, jenis dan contoh
- Ciri -ciri Bioprocesses, Jenis, Kelebihan dan Tahap »

