Asid dan asas perbezaan, ciri, contoh
- 3743
- 800
- Erick Krajcik
The Asid dan pangkalan Mereka adalah sebatian kimia yang tidak membentangkan definisi tunggal, tetapi beberapa, yang bergantung kepada ciri -ciri atau sifat yang dipertimbangkan. Secara umum, boleh dikatakan bahawa asid adalah bahan masam, sementara pangkalannya adalah saponáceas atau sabun.
Takrif yang paling penting, seperti Brönsted-Lowry, atau Arrhenius, lebih fokus pada pembebasan ion H3Sama ada+ (Hydronium) u oh-(hidroksil) oleh bahan -bahan ini. Sama ada dalam bentuk yang tulen atau dibubarkan di dalam air.
Definisi yang timbul akibat daripada perkara di atas adalah berikut: Asid yang dibubarkan dalam air menjana penyelesaian dengan nilai pH lebih kecil daripada 7, manakala pangkalan terlarut menghasilkan penyelesaian dengan nilai pH lebih besar daripada 7. PH adalah cara untuk menyatakan bagaimana berasid atau asas adalah cecair dengan mengambil kira kepekatan h3Sama ada+.
Oleh itu, bahan berasid, seperti jus oren, mempunyai pH kurang daripada 7 dan banyak ion3Sama ada+. Walaupun pangkalan, seperti legía, mempunyai pH lebih besar daripada 7 dan banyak ion oh-.
Asid | Pangkalan | |
Jenis bahan | Bahan Agrarian. | Bahan Jabonesas. |
Ph | pH kurang daripada 7. | pH lebih besar daripada 7. |
Rasa | Masam. | Pahit. |
Pewarnaan | Kertas DAS RED. | Cornstasol kertas pewarna biru. |
Ciri -ciri | Mereka mengandungi dan melepaskan hidrogen. | Beberapa kumpulan OH hadir. |
Kakisan | Mereka menghakis. | Mereka tidak mengakis. |
Contoh | Asid hidroklorik, asid sulfurik, asid klorik. | Lithium hidroksida, ammonia, natrium hidroksida. |
Asid
 Jus oren adalah salah satu wakil asid yang paling terkenal dalam kehidupan seharian kita
Jus oren adalah salah satu wakil asid yang paling terkenal dalam kehidupan seharian kita Ciri -ciri asid
Bahan asid mempunyai ciri -ciri tertentu:
Rasa masam
Asid mempunyai rasa masam. Secara rutin, sejenis rasa ditetapkan dengan istilah 'asid'. Oleh itu, dikatakan bahawa jus lemon dan cecair beberapa gusi adalah asid, kerana perisanya masam dan kuat untuk langit -langit.
Kertas DAS RED
Asid adalah bahan yang mampu mengubah warna kertas semburan biru ke merah. Shortasol adalah sebahagian daripada satu set bahan yang boleh mengubah warna bergantung pada tahap keasidan atau asas persekitaran di mana ia dijumpai. Bahan -bahan ini dipanggil petunjuk pH.
Boleh melayani anda: Ciri -ciri penyelesaian koligatifMereka mengandungi dan melepaskan hidrogen
Asid adalah sebatian kimia yang mempunyai elemen kimia hidrogen (H), yang memberikan ciri keasidannya.
Banyak bahan lain juga mengandungi hidrogen, tetapi mereka tidak dapat melepaskannya kerana ia berlaku dengan asid. Apabila membebaskan, hidrogen adalah dalam bentuk ion atau cation+. H+, Semasa memenuhi molekul air, mereka ditambah kepada ini untuk membentuk ion -i3Sama ada+.
Mereka mengangkut arus elektrik
Kerana atom H+ yang dibebaskan apabila asid di dalam air dibubarkan, ini dapat mengangkut elektrik melalui penggunaan bateri atau bateri.
Mereka menghakis
Terdapat asid kuat yang sangat mengakis. Oleh itu, hubungan dengan mereka harus dielakkan, kerana mereka boleh menyebabkan kerosakan fizikal yang teruk. Malah asid lemah, pada kepekatan yang sangat tinggi, seperti asetik (cuka) boleh membakar kulit dan pharynx jika wap mereka dihembuskan.
Kuat dan lemah
Asid kuat menghasilkan kepekatan besar ion3Sama ada+ Semasa mereka larut di dalam air. Dikatakan bahawa atom hidrogen asid kuat mudah dipisahkan. Sementara itu, asid lemah melepaskan beberapa atom hidrogen dan, oleh itu, menghasilkan kepekatan ion yang lebih rendah3Sama ada+.
Asid kuat mempunyai pH yang sangat rendah, yang bergantung kepada kepekatan dan daya asid, boleh menjadi 1 atau kurang. Sebaliknya, asid lemah mempunyai pH berasid yang lebih tinggi, yang boleh menjadi contoh 4 atau 5.
Asid kuat mempunyai bau yang menghasilkan sensasi terbakar. Sementara itu, asid lemah tidak membentangkan bau jenis ini, walaupun dalam beberapa kes mereka mempunyai bau yang menyenangkan. Walau bagaimanapun, terdapat banyak pengecualian, jadi mereka tidak disyorkan untuk mencium bau walaupun asid lemah.
Boleh melayani anda: Besi oksida (iii): struktur, nomenclature, sifat, kegunaanAsid kuat adalah pengangkut elektrik yang baik. Sebaliknya, asid lemah adalah konduktor elektrik yang buruk dengan melepaskan beberapa atom H+.
Asid kuat dapat menyerang logam, seperti zink, membentuk sejumlah besar gelembung hidrogen. Tindak balas ini tidak dihasilkan oleh asid lemah.
Contoh asid
Asid kuat
-HCL: Asid hidroklorik
-H2SW4: asid sulfurik
-HBR: Asid Bromhydric
-Hai: asid yodhydric
-Hno3: asid nitrik
-Hclo4: asid perchloric
-Hclo3: Asid klorik
Asid lemah
-Ch3COOH: Asid asetik
-Hno2: Asid nitrous
-H2Co3: Asid karbonik
-H3PO4: asid fosforik
-C3H5O (COOH): Asid sitrik
-HF: Asid Fluorhydric
-H2SW3: Asid sulfur
Pangkalan
 Ammonia adalah bahan asas
Ammonia adalah bahan asas Ciri -ciri asas
Pangkalan menunjukkan ciri -ciri berikut:
-Mereka menghasilkan sensasi likat atau sabun di jari, menyebabkan objek diambil oleh tangan untuk menjadi licin.
-Mereka mempunyai rasa pahit.
-Mereka boleh bertindak balas dengan asid, menghasilkan pembentukan sebatian yang disebut garam. Dalam beberapa kes, ini dapat mendakan atau tenggelam ke dalam air. Juga, dalam tindak balas asas dengan asid, air terbentuk.
-Mereka menghidupkan warna kertas bercambah biru, menunjukkan bahawa penyelesaiannya mempunyai pH lebih besar daripada 7 atau alkali.
-Beberapa pangkalan yang terdapat dalam kumpulan formula kimia mereka OH, yang dipanggil hydroxilli, yang dibentuk oleh atom hidrogen dan atom oksigen.
Kuat dan lemah
Pangkalan yang kuat adalah sebatian kimia yang membentangkan satu atau lebih kumpulan OH dalam struktur kimia mereka, yang apabila mereka bersentuhan dengan air memperoleh beban negatif, oh-.
Sementara itu, pangkalan yang lemah tidak terdapat dalam kumpulan formula kimia mereka. Walau bagaimanapun, pangkalan yang lemah apabila bertindak balas dengan air juga menghasilkan ion atau anion oh-.
Pangkalan yang kuat, seperti natrium hidroksida, mempunyai nilai pH yang sangat tinggi, hampir 14. Sementara itu, pangkalan yang lemah mempunyai pH yang lebih rendah, seperti ammonia, yang mempunyai pH 11.
Boleh melayani anda: mendidih: konsep, jenis dan contohPangkalan yang kuat digunakan di rumah untuk membongkar longkang. Begitulah keadaan kalium hidroksida. Sementara itu, pangkalan yang lemah digunakan dalam kerja pembersihan, seperti ammonia yang hadir di banyak pembersih.
Contoh pangkalan
Pangkalan yang kuat
-Lioh: lithium hidroksida
-NaOH: Natrium hidroksida
-KOH: Potassium Hydroxide
-RBOH: Rubidio Hydroxide
-CSOH: Cesium hidroksida
-Sr (oh)2: Strontium hidroksida
-BA (oh)2: Barium hidroksida
Pangkalan lemah
-NH3: Ammonia
-NHET2: Diethylamine
-NH2Ch3: Metilamine
-C5H5N: Pyridine
Perbezaan antara asid dan pangkalan
Ion yang dibebaskan
Asid melepaskan atom H+ atau h3Sama ada+ Semasa mereka larut di dalam air. Sementara itu, pangkalan melepaskan atau menghasilkan hubungan dengan ion air oh-.
Nilai pH
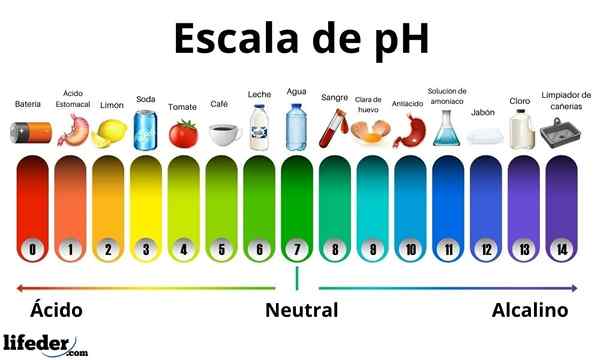
Asid mempunyai nilai pH antara 0 dan 7. Sementara itu, pangkalan mempunyai nilai pH antara 7 dan 14. Oleh itu, asid menghidupkan warna kertas bercambah dan pangkalannya bertukar menjadi biru.
Reaksi Latihan
Asid berasal dari tindak balas unsur -unsur bukan oksida, contohnya klorin, sulfur, dll., Dengan air, atau ia juga dibentuk apabila hidrogen digabungkan dengan elemen bukan logam dan kemudian sebatian yang terbentuk larut dalam air (HF, HCL, HBR, dll.).
Pangkalan ini dihasilkan oleh tindak balas oksida logam, contohnya besi, tembaga, magnesium, dan lain -lain., Dengan air. Harus diingat bahawa oksida adalah gabungan atom oksigen dengan unsur kimia lain.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Helmestine, Anne Marie, Ph.D. (11 Februari 2020). Definisi dan contoh asid. Pulih dari: Thoughtco.com
- Penjelajah Sains. (31 Julai 2018). Mengajar kanak -kanak mengenai asid dan pangkalan. Pulih dari: ScienceExplorers.com
- Penggubalan contoh. (2013). Ciri -ciri asid. Pulih dari: teladan.com
- Kimia lumen untuk bukan major. (s.F.). Sifat asid dan pangkalan. Pulih dari: kursus.Lumenning.com
- Clark Jim. (2013). Pangkalan yang kuat dan lemah. Pulih dari: chemguide.co.UK
- « Flora dan Fauna Spesies Wakil Sierra Ecuador
- Rangka Kerja Metodologi Cara Menulisnya, Struktur, Contoh »

