Enzim kinetik
- 2087
- 382
- Horace Gulgowski
Apakah kinetik enzimatik?
The Enzim kinetik Ini adalah bidang pengajian di mana fizikokimia dan biokimia bertemu untuk mengkaji tindak balas kimia yang dikatal oleh enzim. Enzim adalah pemangkin biologi yang meningkatkan kelajuan tindak balas kimia dengan mengurangkan tenaga pengaktifan mereka.
Enzim memangkin tindak balas kimia yang sangat penting untuk penyelenggaraan kehidupan. Mereka mempunyai kedua -dua pH dan suhu yang optimum untuk menjalankan tindakan pemangkin mereka pada substrat, jadi mereka adalah faktor penting dalam kajian aktiviti mereka.
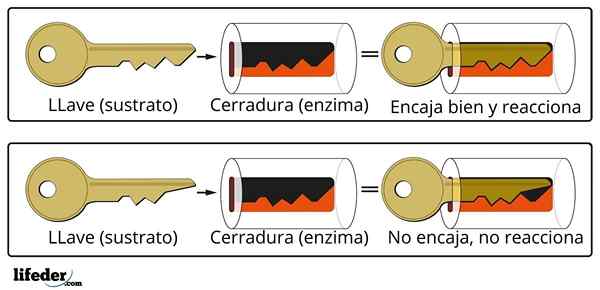
 Sistem penutupan utama adalah analogi anggaran kepada sistem substrat-enzim.
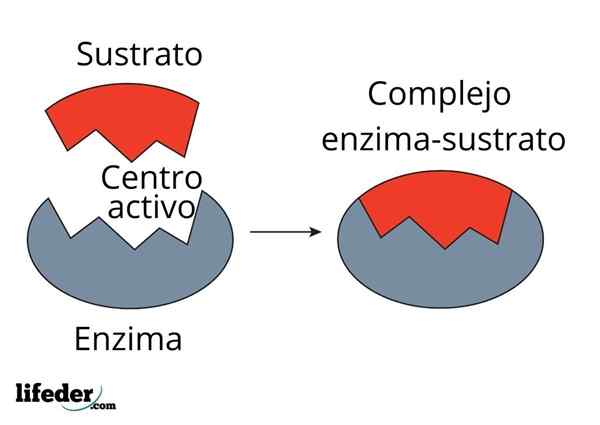
Sistem penutupan utama adalah analogi anggaran kepada sistem substrat-enzim. Enzim berinteraksi dengan substrat melalui rantau khusus rantaian proteinnya, yang dipanggil pusat aktif, yang struktur tiga dimensi ditambah dengan struktur substrat. Interaksi antara pusat aktif dan substrat biasanya lemah dan tidak kovalen.
Bilangan pusat enzim aktif terhad, menghasilkan ketepuannya dengan molekul substrat, yang seterusnya menghalang kelajuan tindak balas daripada meningkatkan nilai tertentu, yang dikenali sebagai kelajuan maksimum.
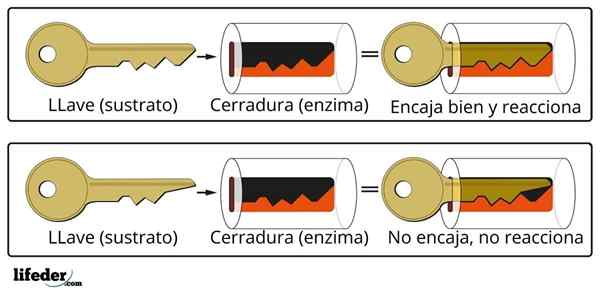
Kinetik enzimatik bukan sahaja menggabungkan biokimia dan fizikokimia, tetapi juga bioinorganik, kimia supramolekul, kimia pengiraan, dan statistik.
Antara model yang menggambarkannya ialah Michaelis -menc. Hari ini masih merupakan salah satu model yang paling banyak digunakan untuk menggambarkan kinetik enzim.
Konsep asas dalam kinetik enzimatik
Pemangkinan enzimatik
Enzim adalah protein, dengan aktiviti pemangkin, mampu bertindak pada molekul yang dipanggil substrat, memangkinkan transformasinya ke bahan lain yang dikenali sebagai produk. Enzim tidak dimakan semasa tindakan pemangkin mereka, kekal jisim mereka yang berterusan.
Aktiviti pemangkin
Aktiviti pemangkin enzim dijalankan dalam struktur tiga dimensi khusus yang dikenali sebagai pusat aktif. Ini dibentuk oleh lipatan rantai protein enzimatik yang menentukan interaksi sekumpulan asid amino yang membentuk pusat aktif.
Pusat aktif
Pusat aktif bukan struktur yang tegar, tetapi mampu menyesuaikan diri dengan geometri ke substrat untuk berinteraksi dengannya. Interaksi umumnya lemah (daya van der Waals), walaupun terdapat enzim yang membentuk hubungan kovalen dengan substrat.
Boleh melayani anda: lemak butyric: mendapatkan, jenis, komposisi, kegunaan, faedahMenurunkan tenaga pengaktifan
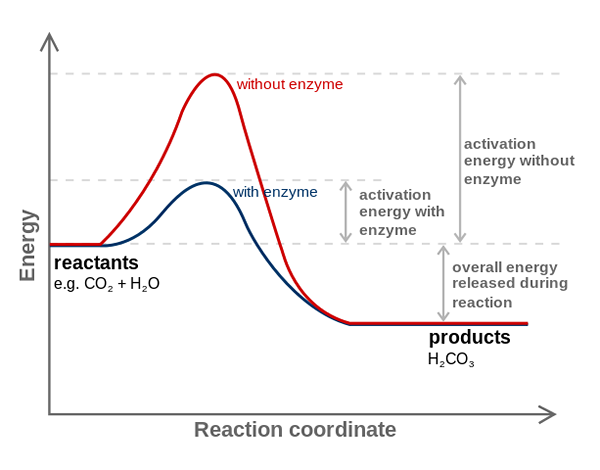 Enzim anhydrase karbonik mengurangkan tenaga pengaktifan untuk penukaran CO2 hingga H2CO3. Sumber: fvasconcellos (bercakap • sumbangan), cc by-sa 3.0, melalui Wikimedia Commons
Enzim anhydrase karbonik mengurangkan tenaga pengaktifan untuk penukaran CO2 hingga H2CO3. Sumber: fvasconcellos (bercakap • sumbangan), cc by-sa 3.0, melalui Wikimedia Commons Enzim memangkinkan tindak balas mengurangkan tenaga pengaktifan, dan oleh itu, juga mengurangkan penggunaan tenaga bebas (g) yang diperlukan untuk menyelesaikan proses yang dikatalisis. Enzim tidak mengubah suai titik keseimbangan tindak balas kimia yang tidak terkurung.
Perhatikan bagaimana enzim anhydrase karbonik mengurangkan tenaga pengaktifan untuk co -conversion2 ke h2Co3. Walaupun jarak antara garis merah dan kebiruan tidak kelihatan, enzim ini meningkatkan kelajuan dalam urutan berjuta -juta kali (106), berbanding dengan reaksi yang dijalankan tanpa penyertaan mereka.
Stereoespecificity
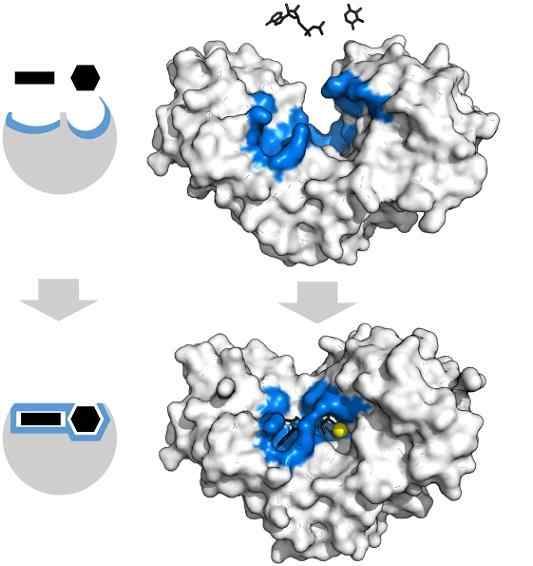 Adenosine substrat tryphosphate dan xylose mempunyai bentuk khusus yang bertepatan dengan geometri pusat aktif enzim heksoquinase. Sumber: Thomas Shafee, CC oleh 4.0, melalui Wikimedia Commons
Adenosine substrat tryphosphate dan xylose mempunyai bentuk khusus yang bertepatan dengan geometri pusat aktif enzim heksoquinase. Sumber: Thomas Shafee, CC oleh 4.0, melalui Wikimedia Commons Enzim, secara umum, sangat spesifik untuk reaksi yang mereka pemangkin, kerana molekul substrat mesti berinteraksi dengan pusat aktif yang membentangkan satu set keperluan untuk gandingan mereka dengannya.
Oleh itu, sebagai contoh, pusat aktif hexoquinase, yang dinamik kerana getaran molekul rantai protein, menawarkan kumpulan dalam orientasi spatial yang tepat supaya molekul adenosin dan xilosa adenosin, kapur sehingga jika mereka mengisi geometri.
Gangguan fizikal atau kimia yang sedikit, dan rantau biru -hequinase tidak lagi dapat menampung substrat.
Kelajuan maksimum
Enzim mempunyai bilangan pusat aktif yang terhad, jadi dengan meningkatkan kepekatan substrat. Ini menentukan bahawa kelajuan tindak balas yang dipangkin tidak dapat meningkat melebihi nilai tertentu, yang dikenali sebagai kelajuan maksimum.
Kepekaan suhu dan pH
Aktiviti pemangkin enzimatik bergantung kepada suhu dan pH, mempunyai nilai optimum parameter ini untuk operasinya. Begitu juga, kerana ia adalah molekul protein enzim, mereka terdedah kepada denaturasi kimia atau terma.
Cofactors
Beberapa enzim meningkatkan aktiviti pemangkin mereka kerana pengaruh faktor -faktor tertentu, yang boleh menjadi logam atau sebatian organik yang dikenali sebagai koenzim.
Begitu juga, enzim dapat dihalang secara kompetitif dan tidak bersaing. Dalam kes hexoquinase dari atas, mg2+ (Sfera Kuning) bertindak sebagai cofactor.
Kadar tindak balas enzimatik
Kelajuan tindak balas enzimatik bergantung kepada kepekatan substrat dan kepekatan enzimatik. Apabila kepekatan substrat rendah, terdapat hubungan hampir linear antara kelajuan enzimatik dan kepekatan substrat.
Ia boleh melayani anda: tiada logam: sejarah, sifat, kumpulan, kegunaanOleh itu, kelajuan enzimatik meningkat dalam perkadaran langsung kepada kepekatan substrat; Tetapi dengan meningkatkan kepekatan substrat ke nilai yang menembusi tapak aktif enzim, kelajuan maksimum dicapai.
Sebaik sahaja kelajuan enzimatik berlaku, ia menjadi malar, iaitu, bebas daripada kepekatan substrat dan dikatakan bahawa kelajuan enzimatik adalah sifar. Di samping itu, kelajuan enzimatik pemangkin adalah berkadar dengan kepekatan kompleks enzim-substrat [IS].
Seperti yang ditunjukkan oleh ungkapan matematik:
V = k2[Adakah]
Kelajuan maksimum adalah berkadar terus dengan jumlah kepekatan enzim, seperti yang terdapat dalam formula berikut:
VMaks = KKucingDant
KKucing Ia adalah nombor putaran atau penggantian dan mewakili bilangan molekul substrat yang setiap tapak enzimatik berubah menjadi produk per unit masa. Manakalat mewakili bilangan tapak enzimatik pemangkin. Yat Ia mempunyai nilai yang tinggi, lebih tinggi [s] diperlukan untuk menenun tapak atau pusat aktif.
Persamaan Michaelis
Model
Model Mihaelis -mente didasarkan pada tindakan enzim yang bertindak pada substrat yang mudah dan tidak berkenaan dengan enzim alosterik; iaitu, mereka yang mempunyai rantau pengawalseliaan aktiviti pemangkin tapak aktif.
Enzim pada kepekatan substrat yang rendah, mempunyai aktiviti pemangkin yang linear dengan kepekatan substrat; Tetapi pada kepekatan substrat yang tinggi, aktiviti pemangkin adalah bebas daripada kepekatan substrat.
Pada tahun 1913, Leonor Michelis dan Maud berfikiran mencadangkan model untuk menerangkan tingkah laku enzimatik yang ditunjukkan, kewujudan kompleks perantara enzim-Sustrato adalah penting dalam model [IS].
Persamaan Umum
Hubungan kompleks ini dengan komponen lain dalam proses enzimatik, serta dengan pemalar (k) yang mengaitkannya, ditunjukkan dalam skema berikut:
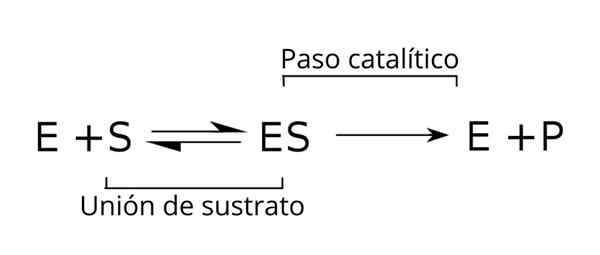 Persamaan umum substrat, kompleks enzim substrat dan produk kinetik enzimatik. Sumber: Tim Vickers melalui Wikipedia.
Persamaan umum substrat, kompleks enzim substrat dan produk kinetik enzimatik. Sumber: Tim Vickers melalui Wikipedia. Enzim (e) digabungkan dengan substrat (s) untuk membentuk kompleks enzim substrat dengan pemalar K-speed1. Kompleks E-S boleh memisahkan E dan S dengan kelajuan tindak balas tindak balas k-1.
Begitu juga, kompleks itu boleh menyebabkan produk (p) dan pemisahan enzim, yang boleh dikitar semula untuk memenuhi kitaran lain aktiviti enzimatik. Keadaan keseimbangan dapat dicapai untuk negeri [adalah] di mana kelajuan pembentukannya sama dengan kelajuan penguraiannya.
Ia dapat melayani anda: elemen kimia semulajadiK1[IS] [s] = (k-1 + K2) [IS] (1)
Mengumpulkan semula terma dan penjelasan [adalah], anda mempunyai:
[IS] = ([E] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM Ia adalah berterusan yang diperkenalkan oleh Michaelis.
Syarat Persamaan Michaelis -Mente
Menggantikan sekarang kM Dalam (2) kita teruskan:
[IS] = [E] [s] / kM (3)
Kepekatan enzim yang tidak disusun adalah:
[E] = [eT] - [es] (4)
Di mana [e] adalah enzim percuma dan [eT] Jumlah kepekatan enzim.
Menggabungkan Persamaan 3 dan 4, membuat penggantian, dan juga mengambil kira vMaks, Persamaan Michaelis-Muene dicapai, dinyatakan dengan cara berikut:
V = (vMaks [S]) / ([s] + kM)
Halaju maksimum tindak balas enzimatik berlaku apabila kepekatan substrat jauh lebih besar daripada kM Dan tapak pemangkin enzim tepu dengan substrat. Ini berlaku apabila hubungan [s]/[s] + kM Pendekatan kepada 1.
Bila [s] sama dengan kM, Bahagian persamaan [s] / [s] + kM sama dengan 1/2, menunjukkan bahawa kM Ia adalah kepekatan substrat yang menghasilkan kadar tindak balas enzimatik yang separuh kelajuan maksimum.
Di samping itu, kM Ia adalah ukuran pertalian enzim oleh substrat: semakin besar nilai kM, Minor akan menjadi pertalian enzim untuk substrat dan sebaliknya. Oleh itu, ke kM tinggi kelajuan tindak balas enzimatik akan rendah.
Graf lineweaver-burk
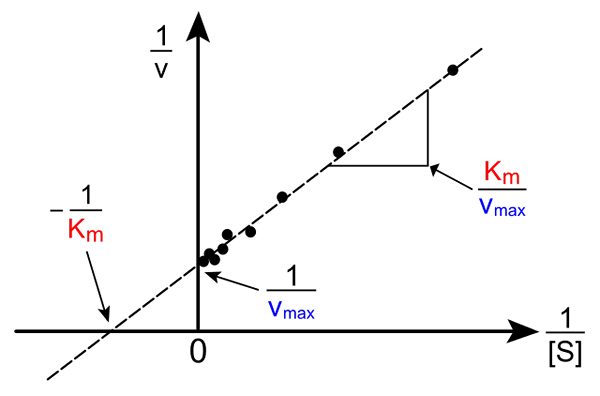 Lineweaver-burk lurus. Sumber: Pro Bug Catcher melalui Wikipedia.
Lineweaver-burk lurus. Sumber: Pro Bug Catcher melalui Wikipedia. Transformasi persamaan Michaelis-Muene untuk menghasilkan bentuk songsang mempunyai bentuk berikut:
1/v = (kM / VMaks) (1 / [s]) + 1 / vMaks
Kepentingan garis ini ialah ia mempunyai persimpangan dengan paksi x dalam - 1/kM, dan dengan paksi y pada y = 1/vMaks (gambar atas). Garis mempunyai cerun kM/Vmax. Ini membolehkan maklumat mengenai vMaks dan kM Grafik kelajuan terbalik bergantung kepada kebalikan dari kepekatan substrat.
Rujukan
- Strayer, l. (1975). Biokimia. 2memberi Edisi. Editorial kembali.
- Iran. Levine. (2009). Prinsip Fizikokimia. Edisi keenam. MC Graw Hill.
- Wikipedia. (2020). Kinetika enzim. Diperoleh dari: dalam.Wikipedia.org
- Michael Blaber. (5 Jun, 2019). Kinetika enzim. Biologi Liberxts. Pulih dari: bio.Libretxts.org
- Editor enyclopaedia Britannica. (2020). Kinetika Michaelis-Muen. Pulih dari: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biokimia. Edisi ke -5. New York: W H Freeman; (2002). Seksyen 8.4: Model Michaelis menyumbang sifat kinetik banyak enzim. Pulih dari: NCBI.NLM.NIH.Gov

