Struktur, sifat, penggunaan, risiko natrium sodium (NaClo2)

- 4678
- 1455
- Donnie Ryan
Dia natrium klorit Ia adalah pepejal bukan organik yang dibentuk oleh natrium ion na+ dan CLO klorit ion2-. Formula kimianya adalah naclo2. Ia adalah pepejal putih kristal, selain menjadi ejen pengoksidaan yang kuat. Oleh itu, ia mesti berhati -hati.
Penggunaan utamanya adalah sebagai ejen pembasmi kuman untuk banyak aplikasi. Ia membolehkan untuk menghapuskan mikrob pada permukaan seperti lantai, dinding dan peralatan makmal di hospital dan klinik dan sistem air mereka.
 Sodium Chlorite NaClo2 pepejal. Pengarang: ChemicalInterest . Sumber: Wikimedia Commons.
Sodium Chlorite NaClo2 pepejal. Pengarang: ChemicalInterest . Sumber: Wikimedia Commons. Juga dalam kemudahan pertanian dan veterinar, untuk menghidupkan inkubator telur burung, untuk mengawal jangkitan lembu tenusu, untuk membasmi sistem air untuk haiwan, dll.
Dalam industri makanan, penyelesaian berair berasid mereka berfungsi untuk mencuci daging, ayam, buah -buahan, sayur -sayuran, serta peralatan kemudahan tersebut.
Dengan natrium klorit, klorin dioksida boleh disediakan2 di tapak penggunaan, yang membolehkan anda menghapuskan mikrob, bau buruk dan perisa air supaya ia menyenangkan dan boleh diminum tanpa masalah.
Ia juga berfungsi untuk pulpa kertas peluntur, gentian tekstil sayur dan minyak, antara aplikasi lain.
NaClo2 pepejal mesti dikendalikan dengan berhati -hati, kerana bersentuhan dengan letupan bahan tertentu boleh berlaku. Penyelesaian mereka agak mudah untuk dimanipulasi tetapi mereka sangat mengoksidakan dan mengakis.
[TOC]
Struktur
Natrium klorit terdiri daripada sodium na kation+ dan clo klorit anion2- Oleh itu mereka bersatu dengan ikatan ionik.
Anion klorit mempunyai atom klorin dalam keadaan pengoksidaan +3 dan dua atom oksigen dengan valencia -2 setiap satu. Atas sebab ini anion klorit mempunyai beban negatif.
Ia juga mempunyai struktur berbentuk sudut.
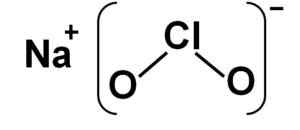 Struktur naclo natrium klorite2. Pengarang: Marilú Stea.
Struktur naclo natrium klorite2. Pengarang: Marilú Stea. Nomenclature
- Natrium klorit
- Natrium klorit
- Garam natrium chloro
Sifat
Keadaan fizikal
Pepejal putih kristal.
Berat molekul
90.44 g/mol.
Takat lebur
Ia terurai kerana ia cair antara 180 dan 200 ºC.
Ketumpatan
2,468 g/cm3
Kelarutan
Air larut: 64 g/100 g air pada 17 ºC. Sedikit larut dalam metanol.
Sifat lain
Ia sedikit hygroscopic.
Ia adalah ejen pengoksidaan yang kuat. Bertindak balas dengan ganas dengan bahan dan pengurangan yang mudah terbakar. Bertindak balas dengan ganas dengan asid, menghasilkan cLO klorin dioksida2.
Boleh melayani anda: Peraturan Hume-RotheryPenyelesaian alkali (ini bermakna dengan kehadiran contoh NaOH) agak stabil, manakala dalam medium berasid, asid chloro HClo terbentuk2, yang mana yang terurai dengan cepat:
4 hclo2 → 2 clo2↑ + CLO3- + Cl- + 2 jam+ + H2Sama ada
Risiko
Kedua -dua NaClo2 Pepejal kerana penyelesaian berair mereka berpotensi berbahaya dan memerlukan banyak perhatian dan pengalaman semasa manipulasi dan penyimpanan mereka.
NaClo2 Pepejal boleh meletup apabila bersentuhan dengan bahan organik termasuk sarung tangan dan pakaian, tumpahan bahan -bahan kawalan seperti habuk papan dan kapas sisa, serta minyak dan lemak.
Oleh itu, bentuk pepejal sangat sukar untuk diangkut dan lebih disukai menggunakannya dalam bentuk penyelesaian berair.
Penyelesaian ini sangat mengakis. Mereka sebaiknya menyimpan pH di atas 8, iaitu, pH alkali.
NaClo2 mempercepat pembakaran sebatian atau bahan mudah terbakar, sehingga ia dapat membentuk campuran letupan dengan ini.
Sekiranya dipanaskan, memancarkan asap toksik asid hidroklorik HCl dan natrium oksida NA2Sama ada. Sekiranya ia diperpanjang untuk memanaskan atau api, ia dapat mengeksploitasi.
Memperoleh
Ia disediakan bermula dengan pengurangan kimia atau elektrokimia sodio naclo3, Dengan kehadiran asid hidroklorik HCl untuk menghasilkan cLO klorin dioksida2.
Yang terakhir bertindak balas dengan hidrogen peroksida h2Sama ada2 Dalam larutan akueus natrium hidroksida NaOH dan larutan natrium natrium klorit diperolehi2, yang menyejat dan mengkristal pepejal.
Ia juga boleh didapati dengan lulus gas klorin dioksida2 Untuk penyelesaian NaOH.
2 clo2 + 2 NaOH → NaClo2 + NaClo3 + H2Sama ada
Aplikasi
Sebagai mikrobisida dan pembasmi kuman dalam pelbagai aplikasi
Ini adalah ramuan pelbagai produk yang berfungsi untuk mengawal bakteria, kulat dan enapcemar atau lumpur alga. Produk yang mengandunginya untuk tujuan ini digunakan dalam pertanian, perdagangan, industri dan kediaman atau rumah.
Ia berfungsi sebagai pembasmi kuman pelbagai jenis bahan dan permukaan.
Dalam pertanian, ternakan dan industri yang serupa dibasmi permukaan keras, peralatan, kemudahan untuk pengeraman telur burung, rumah hijau untuk kulat seperti cendawan, dan penyejukan sistem air dan air untuk pena burung.
Ia mempunyai penggunaan veterinar sebagai pembasmi kuman topikal dalam kawalan mastitis lembu tenusu, untuk membenamkan puting haiwan. Mastitis adalah jangkitan lembu lembu.
Boleh melayani anda: proses adiabatik: jenis, contoh, latihan yang diselesaikan Kadang -kadang anda perlu melibatkan lembu dalam penyelesaian natrium klorit untuk mengelakkan jangkitan di dalamnya. Pengarang: Hans Braxmeier. Sumber: Pixabay.
Kadang -kadang anda perlu melibatkan lembu dalam penyelesaian natrium klorit untuk mengelakkan jangkitan di dalamnya. Pengarang: Hans Braxmeier. Sumber: Pixabay. Ia juga digunakan di pertubuhan penyelidikan semula jadi untuk menyahpasang makmal.
Kegunaan komersial, perindustrian dan perubatan termasuk membasmi sistem pengudaraan, permukaan keras (seperti lantai, dinding, peralatan makmal) dan sistem air.
Di kemudahan penjagaan kesihatan seperti klinik dan hospital, ia digunakan untuk menghilangkan bilik, koridor, kawasan penebat dan pensterilan bahan.
Ia juga berguna untuk membasmi pertubuhan di mana orang menjalani rawatan kesihatan air atau spa.
Dalam industri makanan ia digunakan sebagai fumigant untuk memulihara makanan.
Ia digunakan dalam bentuk natrium klorit yang berasid. Ini dihasilkan dengan menambahkan asid gred makanan (contohnya, asid sitrik, asid fosforik, asid roda atau asid natrium sulfat) kepada larutan akueus natrium klorit.
Natrium klorit berasid mempunyai sifat antimikrob dan digunakan sebagai embun atau mencuci ayam atau larutan perendaman, daging, sayur -sayuran, buah -buahan dan produk laut. Juga di dalam air untuk membekukan ayam atau burung.
Di isi rumah ia membolehkan untuk membasmi permukaan keras, seperti lantai dan bilik mandi, pemanasan atau sistem penghawa dingin dan sistem peredaran air kolam renang.
 Untuk membasmi kolam kuman, anda boleh menggunakan naclo natrium chlorite2. Pengarang: Kumpulan Global Umur. Sumber: Pixabay.
Untuk membasmi kolam kuman, anda boleh menggunakan naclo natrium chlorite2. Pengarang: Kumpulan Global Umur. Sumber: Pixabay.  Produk yang mengandungi natrium klorit membolehkan bilik mandi tandas. Pengarang: Michal Jarmoluk. Sumber: Pixabay.
Produk yang mengandungi natrium klorit membolehkan bilik mandi tandas. Pengarang: Michal Jarmoluk. Sumber: Pixabay. Ia juga dijual dalam sachet kecil bersama -sama dengan sebatian lain untuk melepaskan gas dan kawalan bau di rumah.
Untuk membasmi air minuman
Ia digunakan dalam pemurnian air untuk diminum, bertindak sebagai oksidan, meningkatkan rasa dan bau air minuman.
Natrium klorit digunakan secara meluas sebagai pendahulu untuk penjanaan clo klorin dioksida2 yang berfungsi untuk merawat air minuman untuk penggunaan manusia, iaitu, untuk menghapuskan mikroorganisma, bau dan rasa yang tidak menyenangkan dan boleh minum.
Untuk menjana CLO2 HCL boleh digunakan:
5 NaClo2 + 4 HCl → 4 CLO2↑ + 5 NaCl + 2 jam2Sama ada
CLO2 Ia adalah agen antimikrob dari oksidan tindakan tinggi dan spektrum luas. Iaitu, bertindak terhadap sebilangan besar mikroorganisma.
Ia boleh melayani anda: kalium nitrit (KNO2): struktur, sifat dan kegunaanMikroorganisma dinyahaktifkan kerana CLO2 mengganggu enzim penting ini dan dengan protein membran sel. Ia juga mempunyai kelebihan bahawa ia tidak menghasilkan sebatian organoklorin, yang beracun.
Ada untuk dijual tablet natrium klorit dicampur dengan sebatian lain yang dibubarkan di dalam air dan segera menghasilkan CLO2 dengan cara yang terkawal, dengan itu membasmi air.
 Natrium klorit digunakan dengan sebatian lain untuk mendapatkan air minuman sedia untuk diminum. Pengarang: Ulrike Leone. Sumber: Pixabay.
Natrium klorit digunakan dengan sebatian lain untuk mendapatkan air minuman sedia untuk diminum. Pengarang: Ulrike Leone. Sumber: Pixabay. Masalah utama merawat air untuk menghilangkan rasa dan bau melalui CLO2 Ia terdiri daripada garam klorit dan klorin toksik yang boleh dibentuk semasa rawatan.
Untuk penjagaan kanta kenalan
NaClo2 Ini adalah komponen penyelesaian yang digunakan untuk membasmi kanta lekap.
Gabungan NaClo digunakan2 dan jejak (kuantiti yang sangat kecil) hidrogen peroksida h2Sama ada2.
H2Sama ada2 Menstabilkan CLO2 yang terbentuk dan gabungan kedua -duanya sangat berkesan terhadap bakteria, kulat dan ragi. Produk yang kemudiannya adalah natrium klorida, air dan oksigen, yang tidak berbahaya, yang bermaksud bahawa mereka tidak berbahaya kepada mata.
Apabila kanta dikeluarkan dari larutan, NaClo2 sisa mengurai dengan cepat di nall dan o2. Sisa peroksida tidak mengganggu mata. Oleh itu penyelesaian ini sangat selamat.
 Penyelesaian untuk membasmi kanta sentuh mempunyai natrium klorit di antara bahan -bahan mereka. Pengarang: nieuw ~ commonswiki. Sumber: Wikimedia Commons.
Penyelesaian untuk membasmi kanta sentuh mempunyai natrium klorit di antara bahan -bahan mereka. Pengarang: nieuw ~ commonswiki. Sumber: Wikimedia Commons. Dalam pelbagai aplikasi
Natrium klorit digunakan untuk penyediaan klorin dioksida2 untuk kegunaan segera dalam sebilangan besar aplikasi yang mana ada yang dirawat dalam perenggan sebelumnya.
Ia berfungsi untuk memotong pulpa kayu, tekstil seperti kapas, serat tumbuhan, minyak yang boleh dimakan dan tidak boleh dimakan, lemak, varnis, lacquers dan lilin.
Ia adalah komponen titisan mata dan beberapa penyelesaian untuk mencuci lisan.
Ia digunakan dalam industri pemprosesan kulit dan ejen untuk elektrod logam (salutan logam).
Rujukan
- Williams, l. et al. (2019). Mikrobiologi, penjagaan lensa dan penyelenggaraan. Dalam kanta kenalan (edisi keenam). Pulih dari Scientedirect.com.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Natrium klorit. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Kelabu, n.F. (2014). Klorin dioksida. Teknologi proses. Dalam Mikrobiologi Penyakit Waterborne (edisi kedua). Pulih dari Scientedirect.com.
- McKen, l. (2012). Pengenalan kepada Foodradition dan Sterilisasi Perubatan. Klorin dioksida. Berkesan pensterilan pada plastik dan elastomer (edisi ketiga). Pulih dari Scientedirect.com.
- Ortenberg, e. dan Telsch, b. (2003). Rasa rasa dan bau di air yang boleh diminum. Dalam Buku Panduan Mikrobiologi Air dan Air Sisa. Pulih dari Scientedirect.com.
- Karsa, d.R. (2007). Biosida. Klorin dioksida. Dalam buku panduan untuk pembersihan/dekontaminasi permukaan. Pulih dari Scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Ensiklopedia Kimia Perindustrian Ullmann. (1990). Edisi Kelima. VCH Verlagsgellschaft MBH.

