Tin Chloride (II)
- 2146
- 203
- Delbert Dare
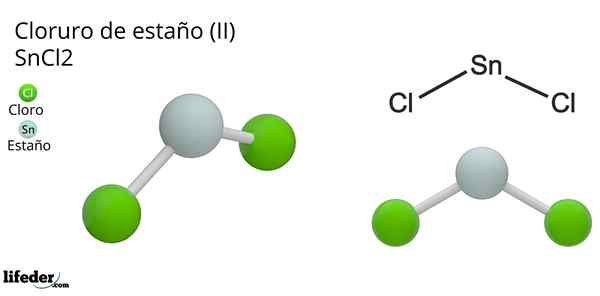
Dia Tin Chloride (Ii) atau klorida kecil, formula kimia sncl2, Ia adalah sebatian pepejal putih dan kristal, produk tindak balas timah dan larutan asid hidroklorik pekat: SN (S) + 2HCl (CONC) => SNC2(aq) + h2(g). Proses sintesisnya (penyediaan) terdiri daripada menambahkan kepingan timah untuk bertindak balas dengan asid.
Setelah menambah kepingan timah, dehidrasi dan penghabluran dilakukan sehingga garam tak organik diperolehi. Di sebatian ini, timah telah kehilangan dua elektron lapisan valensnya untuk membentuk pautan dengan atom klorin.
Ini dapat difahami dengan lebih baik jika konfigurasi Valencia timah dipertimbangkan (5s25 px2pdan0pz0), di mana pasangan elektron menduduki orbital px diberikan kepada proton h+, Untuk membentuk molekul hidrogen diatomik. Iaitu, ini adalah tindak balas jenis redoks.
[TOC]
Tin Chloride Properties
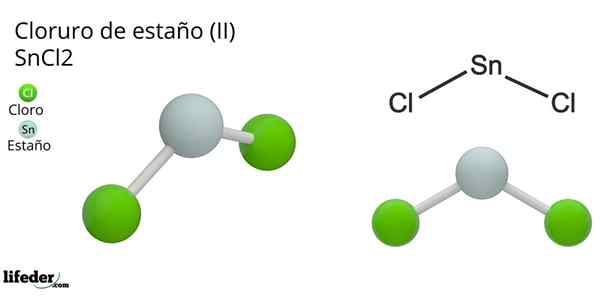
 Tin klorida (ii) dihydrate
Tin klorida (ii) dihydrate Pautan SNCL2 Mereka adalah jenis ionik atau kovalen? Ciri -ciri fizikal timah klorida (ii) membuang pilihan pertama. Titik gabungan dan mendidih untuk sebatian ini adalah 247 ºC dan 623 ºC, menunjukkan interaksi intermolecular yang lemah, fakta umum untuk sebatian kovalen.
Kristalnya putih, yang diterjemahkan ke dalam penyerapan sifar dalam spektrum yang kelihatan.
Konfigurasi Valencia
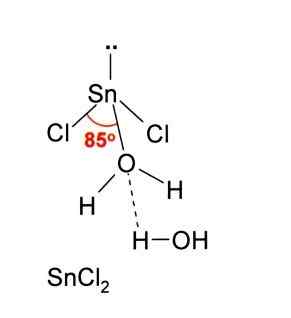
Dalam gambar di atas, pudina terpencil snick digambarkan2.
Geometri molekul harus rata kerana hibridisasi atom pusat adalah SP2 (3 orbital sp2 dan orbital P tulen untuk membentuk ikatan kovalen), tetapi tork bebas elektron menduduki jumlah dan menolak atom klorin ke bawah, memberikan molekul geometri sudut.
Dalam fasa gas sebatian ini diasingkan, jadi ia tidak berinteraksi dengan molekul lain.
Boleh melayani anda: saponifikasiKerana kehilangan sepasang elektron dalam p orbitalx, Timah berubah menjadi sn ion2+ dan konfigurasi elektronik yang dihasilkan adalah 5s25 px0pdan0pz0, Dengan semua orbitalya tersedia untuk menerima pautan dari spesies lain.
Cl ion- Mereka menyelaraskan dengan sn ion2+ Untuk menimbulkan timah klorida. Konfigurasi timah elektronik dalam garam ini adalah 5s25 px2pdan2pz0, dapat menerima pasangan elektron lain di orbital percuma andaz.
Contohnya, anda boleh menerima cl ion lain-, membentuk kompleks geometri rata trigonal (piramid asas segi tiga) dan dimuatkan secara negatif [SNCL3]-.
Reaktiviti
SNCL2 Ia mempunyai kereaktifan dan trend yang tinggi untuk berkelakuan sebagai asid Lewis (reseptor elektron) untuk menyelesaikan oktet Valencia.
Serta menerima ion cl-, Begitu juga untuk air, yang "menghidrat" atom timah apabila molekul air dikaitkan terus ke timah, dan molekul air kedua membentuk interaksi oleh jambatan hidrogen dengan yang pertama.
Hasilnya ialah SNCL2 Ia tidak murni, tetapi diselaraskan dengan air dalam garam dihidrasi: SNCL2· 2h2Sama ada.
SNCL2 Ia sangat larut dalam pelarut air dan kutub, kerana ia adalah sebatian kutub. Walau bagaimanapun, kelarutannya dalam air, kurang daripada berat jisimnya, mengaktifkan tindak balas hidrolisis (pecah molekul air) untuk menghasilkan garam asas dan tidak larut:
SNCL2(aq) + h2Atau (l) SN (OH) Cl (s) + HCl (aq)
Anak panah berganda menunjukkan bahawa keseimbangan ditubuhkan, disukai ke kiri (ke arah reagen) jika kepekatan HCl meningkat. Oleh itu, penyelesaian SNCL2 Pekerja mempunyai pH berasid, untuk mengelakkan pemendakan produk garam yang tidak diingini hidrolisis.
Ia boleh melayani anda: nukleofil: serangan nukleofilik, jenis, contoh, nukleofiliAktiviti reduktif
Bertindak balas dengan oksigen udara untuk membentuk timah klorida (IV) atau klorida adalah:
6 SNCL2(aq) + o2(g) + 2h2Atau (l) => 2SNCL4(aq) + 4SN (OH) Cl (s)
Dalam tindak balas ini, tin mengoksida pembentukan pautan dengan atom oksigen elektronegatif dan meningkatkan bilangan ikatannya dengan atom klorin.
Secara umum, atom elektronegatif halogen (f, cl, br dan i) menstabil2 adalah ejen pengurangan.
Apabila teroksida dan kehilangan semua elektron valensinya, sn ion4+ adalah konfigurasi 5S05 px0pdan0pz0, menjadi sepasang elektron di orbital 5s yang paling sukar untuk "diambil".
Struktur kimia klorida timah
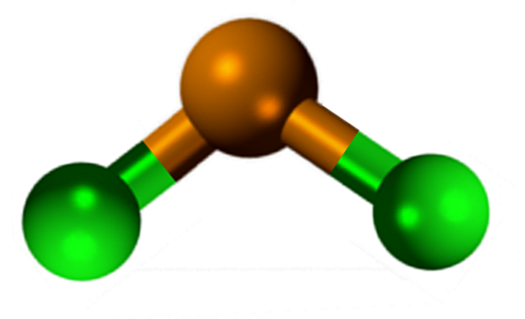 Struktur klorida tin (ii)
Struktur klorida tin (ii) SNCL2 Ia membentangkan struktur kristal jenis ortorrombik, sama dengan baris serruchos, di mana hujung gigi adalah klorida.
Setiap baris adalah rantai SNCL3 Membentuk jambatan CL dengan atom SN yang lain (CL-SN (CL)2-Cl- ···). Dua rantai, bersama-sama dengan interaksi lemah jenis SN-CL membentuk lapisan susunan, yang bertindih di atas lapisan lain, dan sebagainya sehingga menentukan pepejal kristal.
Pasangan elektron percuma 5s2 Menyebabkan gangguan dalam struktur kerana ia menduduki jumlah (jumlah awan elektronik).
SN boleh mempunyai nombor koordinasi yang sama dengan sembilan, yang sama dengan mempunyai sembilan jiran, melukis prisma trigonal dengan ini terletak di tengah -tengah angka geometri dan CL di simpang, sebagai tambahan kepada CL lain yang terletak di setiap satu di setiap satu wajah persegi prisma.
Boleh melayani anda: HydraceIni lebih mudah untuk diperhatikan jika dianggap sebagai rantai di mana sfera SN (sfera kelabu gelap), dan tiga CL dikaitkan dengan bentuk ini lantai segi tiga, sementara tiga pelanggan membentuk bumbung segi tiga atas.
Penggunaan/aplikasi
Dalam sintesis organik ia digunakan sebagai ejen pengurangan sebatian nitro aromatik (AR-NO2 à ar-nh2). Oleh kerana struktur kimianya adalah laminar, ia dapat digunakan dalam dunia pemangkinan reaksi organik, selain menjadi calon yang berpotensi untuk sokongan pemangkin.
Harta pengurangannya dieksploitasi untuk menentukan kehadiran sebatian emas, untuk menutup kaca dengan cermin perak dan berfungsi sebagai antioksidan.
Juga, dalam piramid trigonal geometri molekulnya (: SNX3- M+) digunakan sebagai asas Lewis untuk sintesis sebilangan besar sebatian (seperti kompleks kluster Pt3Sn8Cldua puluh, di mana pasangan bebas elektron diselaraskan dengan asid Lewis).
Risiko
SNCL2 Anda boleh merosakkan sel darah putih. Ia menghakis, menjengkelkan, karsinogenik, dan mempunyai kesan negatif yang tinggi terhadap spesies yang mendiami ekosistem laut.
Boleh terurai pada suhu tinggi, melepaskan gas klorin yang berbahaya. Bersentuhan dengan ejen yang sangat mengoksida mencetuskan reaksi letupan.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. Dalam Unsur -unsur kumpulan 14 (Edisi Keempat., p. 329). MC Graw Hill.
- Buku Kimia. (2017). Buku Kimia: Buku Kimia.com
- Pubchem. (2018). Tin Chloride. Pubchem pulih: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2017). Tin (ii) klorida. Wikipedia pulih: masuk.Wikipedia.org
- F. Hulliger. (1976). Kimia struktur fasa jenis lapisan. P-120,121. D. Syarikat Penerbitan Reidel.

