Lead Chloride Properties, Struktur, Kegunaan

- 874
- 10
- Donnie Ryan
Dia memimpin klorida Ia adalah garam bukan organik yang formula kimia adalah pbcln, Di mana n ialah bilangan pengoksidaan yang memimpin. Oleh itu, apabila plumbum seperti +2 atau +4, garam adalah pbcl2 atau PBCL4, masing -masing. Oleh itu, terdapat dua jenis klorida untuk logam ini.
Daripada kedua -duanya, PBCL2 Ia adalah yang paling penting dan stabil; manakala PBCL4 tidak stabil dan kurang berguna. Yang pertama adalah sifat ionik, di mana kation pb2+ menjana interaksi elektrostatik dengan anion cl- untuk membina rangkaian kristal; Dan yang kedua, adalah kovalen, dengan pautan pb-cl yang berasal dari tetrahedron plumbum dan klorin.
 Jarum PBCL2 yang dicetuskan. Sumber: Rrausch1974 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Jarum PBCL2 yang dicetuskan. Sumber: Rrausch1974 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Satu lagi perbezaan antara klorida plumbum ialah PBCL2 Ia adalah pepejal kristal berbentuk kaca putih (imej unggul); manakala PBCL4 Ia adalah minyak kekuningan yang boleh mengkristalisasi pada -15ºC. Input PBCL2 Ia lebih estetika daripada pbcl4.
Sebagai tambahan kepada yang disebutkan di atas, PBCL2 Ia didapati dalam alam semula jadi sebagai mineral cotunite; manakala PBCL4 Tidak, kerana ia terdedah kepada penguraian. Semasa dari PBCL4 Anda boleh mendapatkan PBO2, daripada PBCL2 Mereka memperoleh pelbagai sebatian organomethalic yang tidak berkesudahan.
[TOC]
Sifat
Ciri -ciri klorida plumbum bergantung pada intipati bilangan pengoksidaan yang memimpin; Oleh kerana, klorin tidak berubah, tetapi cara ia berinteraksi dengan plumbum. Oleh itu, kedua -dua sebatian mesti ditangani; Lead Chloride (ii) di satu pihak, dan memimpin klorida (iv) di pihak yang lain.
-Lead Chloride (II)
Jisim molar
278.10 g/mol.
Penampilan fizikal
Kristal berwarna putih dengan bentuk jarum.
Ketumpatan
5.85 g/ml.
Takat lebur
501ºC.
Takat didih
950ºC.
Kelarutan air
10.8 g/l pada 20ºC. Ia sedikit larut dan air mesti dipanaskan supaya jumlah yang banyak dapat dibubarkan.
Ia boleh melayani anda: Nikel hidroksida (ii): Struktur, sifat, kegunaan, risikoIndeks refraktif
2,199.
Lead Chloride (iv)
Jisim molar
349,012 g/mol.
Penampilan fizikal
Cecair berminyak kekuningan.
Ketumpatan
3.2 g/ml.
Takat lebur
-15ºC.
Takat didih
50ºC. Pada suhu yang lebih tinggi ia memecah melepaskan klorin gas:
PBCL4(s) => pbcl2(s) + cl2(g)
Malah, tindak balas ini boleh menjadi sangat meletup, jadi PBCL disimpan4 Dalam asid sulfurik pada -80ºC.
Struktur
-Lead Chloride (II)
Pada mulanya, sebutkan dibuat bahawa PBCL2 Ia adalah sebatian ionik, jadi ia terdiri daripada ion Pb2+ dan Cl- yang membina kristal di mana nisbah PB ditubuhkan: CL sama dengan 1: 2; Iaitu, terdapat dua kali ganda dan juga- Apa kation pb2+.
Hasilnya ialah kristal ortorrombik terbentuk yang ionnya boleh diwakili dengan model sfera dan bar seperti pada imej yang lebih rendah.
 Struktur Cotunite. Sumber: Benjah-bmm27 [domain awam].
Struktur Cotunite. Sumber: Benjah-bmm27 [domain awam]. Struktur ini juga sesuai dengan mineral cotunite. Walaupun bar digunakan untuk menunjukkan arah arah pautan ionik, ia tidak boleh dikelirukan dengan pautan kovalen (atau sekurang -kurangnya semata -mata kovalen)).
Dalam kristal ortorrombik kata PB2+ (Sfera grillian) ia mempunyai sembilan cl- (sfera hijau) di sekelilingnya, seolah -olah dia terkunci di dalam prisma segi tiga. Untuk struktur yang rumit, dan ketumpatan ionik rendah Pb2+, Molekul sukar untuk menyelesaikan kaca; sebab mengapa ia sedikit larut dalam air sejuk.
Molekul fasa gas
Apabila tidak kristal mahupun cecair dapat menahan suhu tinggi, ion mula menguap sebagai molekul PBCL2 bijak; iaitu, dengan ikatan kovalen cl-pb-cl dan sudut 98º, seolah-olah ia adalah bumerang. Kemudian dikatakan bahawa fasa gas terdiri daripada molekul PBCL ini2 dan bukan ion yang dibawa oleh arus udara.
Boleh melayani anda: ElektronegativitiLead Chloride (iv)
Sementara itu, PBCL4 Ia adalah sebatian kovalen. Kerana? Kerana kation pb4+ Ia lebih kecil dan juga mempunyai ketumpatan beban ion yang lebih besar daripada PB2+, yang menyebabkan polarisasi yang lebih besar dari awan elektronik CL-. Hasilnya ialah bukannya interaksi PB jenis ionik4+Cl-, Pautan kovalen PB-CL terbentuk.
Memandangkan ini, persamaan antara PBCL difahami4 Dan, sebagai contoh, CCL4; Kedua -duanya dibentangkan sebagai molekul individu tetrahedral. Oleh itu, dijelaskan mengapa klorida plumbum ini adalah minyak kekuningan dalam keadaan normal; Atom CL adalah beberapa yang berkaitan antara satu sama lain dan "slip" apabila dua molekul PBCL4 Mereka sedang datang.
Walau bagaimanapun, apabila suhu turun dan molekul menjadi lebih perlahan, kebarangkalian dan kesan dipole segera meningkat (PBCL4 Ia adalah apolar yang diberikan simetrinya); Dan kemudian, minyak membeku sebagai kristal heksagon kuning:
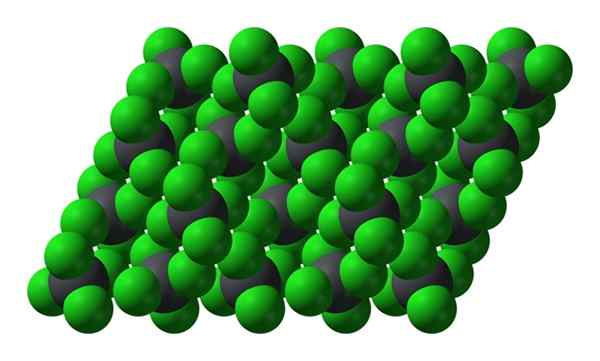 Struktur kristal PBCL4. Sumber: Benjah-bmm27 [domain awam]
Struktur kristal PBCL4. Sumber: Benjah-bmm27 [domain awam] Perhatikan bahawa setiap sfera kelabu dikelilingi oleh empat sfera hijau. Molekul PBCL ini4 "Squeered" membentuk kristal yang tidak stabil dan mudah dijangkiti dengan kuat.
Nomenclature
Nama -nama: Lead Chloride (II) dan Lead Chloride (iv) sesuai dengan yang diberikan mengikut tatanama saham. Oleh kerana nombor pengoksidaan +2 adalah yang terkecil untuk plumbum, dan +4 yang terbesar, kedua -dua klorida boleh dinamakan mengikut tatanama tradisional sebagai plumbose klorida (PBCL2), dan klorida plúbic (PBCL4), masing -masing.
Dan akhirnya adalah tatanama yang sistematik, yang menyoroti bilangan setiap atom kompaun. Oleh itu, PBCL2 Ia adalah dichloride plumbum, dan pbcl4 Lead tetrachloride.
Ia dapat melayani anda: ketidakmampuan kimiaAplikasi
Penggunaan praktikal untuk pbcl tidak diketahui4 Selain melayani sintesis PBO2. Walau bagaimanapun, PBCL2 Ia lebih berguna dan itulah sebabnya hanya beberapa kegunaan untuk klorida plumbum spesifik ini akan disenaraikan di bawah:
- Oleh kerana sifatnya yang sangat luminescent, ia ditakdirkan untuk pengesan fotografi, akustik, optik dan radiasi.
- Tidak menyerap di rantau spektrum inframerah, ia digunakan untuk pembuatan kaca yang menghantar radiasi jenis ini.
- Dia telah menjadi sebahagian daripada apa yang mereka panggil kaca aureno, bahan yang menarik dari warna kebiruan kebiruan yang digunakan untuk tujuan hiasan.
- Juga, mengikuti tema seni, ketika anda dicapai, PBCL2· PB (OH)2 memperoleh warna putih yang kuat, menggunakan pigmen plumbum putih. Walau bagaimanapun, penggunaannya tidak digalakkan kerana ketoksikannya yang tinggi.
- Cair dan dicampur dengan barium titanate, batio3, berasal dari Titanato Seramik Barium dan Lead BA1 -xPbxPaman3. Jika pb2+ Masukkan Batio3, BA2+ Anda mesti meninggalkan kaca untuk membenarkan penggabungannya, dan kemudian dikatakan bahawa pertukaran kation berlaku; Itulah sebabnya komposisi BA2+ Ia dinyatakan sebagai 1-x.
- Dan akhirnya, dari PBCL2 Beberapa sebatian organomethalic rumula formula umum disintesis r4Pb atau r3PB-PBR3.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Memimpin (ii) klorida. Diperoleh dari: dalam.Wikipedia.org
- Perumusan kimia. (2019). Lead Chloride (iv). Pulih dari: formulasi quimica.com
- Clark Jim. (2015). Klorida karbon, silikon, dan plumbum. Pulih dari: chemguide.co.UK
- Kajian bukan linear spektrum dan optik mengenai klorida plumbum (PBCL2) Kristal. [Pdf]. Pulih dari: shodhganga.Infibnet.Ac.dalam
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Memimpin klorida. Pangkalan data PUBCHEM; CID = 24459. Pulih dari: pubchem.NCBI.NLM.NIH.Gov

