Sifat klorida mangan, struktur, kegunaan, risiko

- 2659
- 63
- Julius Dibbert
Dia Mangan klorida Ia adalah garam bukan organik yang formula kimia adalah mcl2. Ia terdiri daripada ion Mn2+ dan Cl- dalam nisbah 1: 2; untuk setiap kation mn2+ Terdapat dua kali dari cl anion-.
Garam ini boleh membentuk beberapa hidrat: MNCL2· 2h2Atau, (dihydrate), mcl2· 4h2Atau (tetrahydrate), dan mcl2· 6h2Atau (hexahydrate) Bentuk garam yang paling biasa adalah tetrahydrate.
 Kristal klorida mangan merah jambu. Sumber: Ondřej Mangl [Domain Awam]
Kristal klorida mangan merah jambu. Sumber: Ondřej Mangl [Domain Awam] Ciri -ciri fizikal klorida mangan seperti ketumpatan, lebur dan kelarutan dalam air, dipengaruhi oleh tahap penghidratan mereka. Sebagai contoh, titik lebur bentuk anhydra jauh lebih besar daripada bentuk tetrahydrate.
Warna mangan klorida berwarna merah jambu pucat (imej unggul). Paleness adalah ciri -ciri logam peralihan garam. Mangan klorida adalah asid Lewis yang lemah.
Mineral yang dikenali sebagai Escacquita adalah bentuk anhydrous semulajadi mangan klorida (II); Seperti Kempita.
Mangan klorida (II) digunakan sebagai agen aloi; Pemangkin dalam reaksi klorinasi, dll.
[TOC]
Ciri-ciri fizikal
Penampilan fizikal
- Bentuk anhydra: kristal padu merah jambu.
- Borang Tetrahydrate: Kristal Monoklinik Merah sedikit halus.
Massa molar
- Anhidro: 125,838 g/mol.
- Dihydrared: 161,874 g/mol.
- Tetrahydrate: 197.91 g/mol.
Mata Fusion
- Anhidro: 654 ºC.
- Dihydrared: 135 ºC.
- Tetrahydrate: 58 ºC.
Takat didih
Borang Anhidra: 1.190 ºC.
Kepadatan
- Anhydrous: 2,977 g/cm3.
- Dihydrared: 2.27 g/cm3.
- Tetrahydrate: 2.01 g/cm3.
Kelarutan air
Borang Anhydra: 63.4 g/100 ml pada 0 ºC; 73.9 g/100 ml pada 20 ºC; 88.5 g/100 ml pada 40 ° C; dan 123.8 g/100 ml pada 100 ° C.
Kelarutan dalam pelarut organik
Larut dalam piridin dan etanol, tidak larut dalam eter.
Penguraian
Kecuali langkah berjaga -jaga yang diambil, dehidrasi bentuk terhidrat ke bentuk anhydrous boleh menyebabkan dehidrasi hidrolisis, dengan pengeluaran hidrogen klorida dan mangan oxychloride.
Ph
Penyelesaian 0.2 m tetrahydrate mangan klorida dalam larutan berair mempunyai pH 5.5.
Boleh melayani anda: kromatogramKestabilan
Ia stabil, tetapi sensitif terhadap kelembapan dan tidak serasi dengan asid kuat, logam reaktif dan hidrogen peroksida.
Struktur klorida mangan
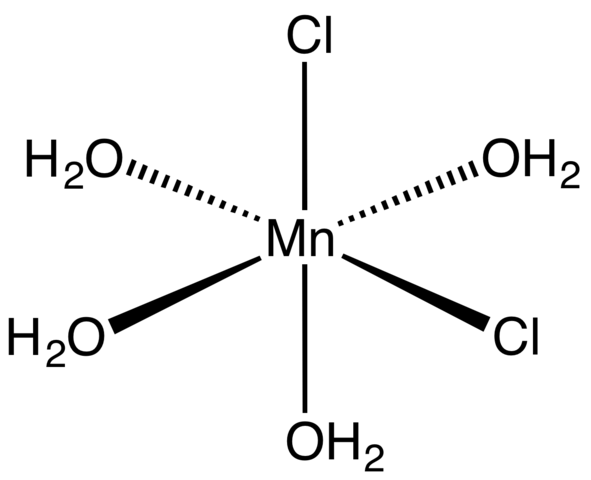 Kompleks koordinasi untuk tetrahydrate MNCL2. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Kompleks koordinasi untuk tetrahydrate MNCL2. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Bermula dengan garam tetrahydrate, merah jambu dan kristal yang menarik, ia harus terdiri daripada kompleks koordinasi (imej unggul). Di dalamnya, pusat logam MN2+ dikelilingi oleh octahedron yang ditakrifkan oleh molekul empat h2Atau dan dua cl anion-.
Perhatikan bahawa ligan CL- Mereka berada dalam kedudukan cis; Semuanya bersamaan dengan asas segi empat tepat dari oktain, dan tidak kira jika CL "dipindahkan"- kepada mana -mana tiga jawatan yang lain. Isomer lain yang mungkin untuk molekul yang diselaraskan ini adalah di mana kedua -dua Cl- Mereka berada dalam kedudukan trans; iaitu, di hujung yang berbeza (satu di atas dan yang lain di bawah).
Empat molekul air dengan jambatan hidrogen mereka membolehkan dua atau lebih octahedra untuk bergabung dengan pasukan dipole-dipolo. Jambatan ini sangat berarah, dan menambah interaksi elektrostatik antara MN2+ dan Cl-, Mereka menubuhkan ciri struktur teratur kristal.
Warna merah jambu mncl2· 4h2Atau disebabkan oleh peralihan elektronik MN2+ dan konfigurasi dnya5. Begitu juga, gangguan yang disebabkan oleh sekitar molekul air dan klorida mengubah suai jumlah tenaga yang diperlukan yang mesti diserap5 Untuk mengembara tahap tenaga yang lebih tinggi.
Dihydrate
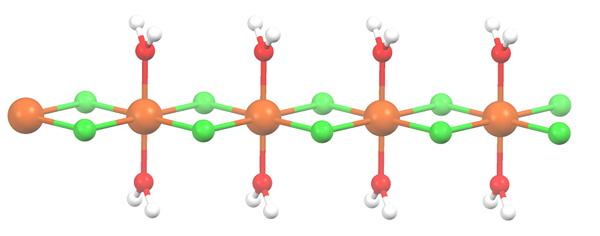 Struktur polimer untuk MNCL2 · 2H2O. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Struktur polimer untuk MNCL2 · 2H2O. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Garam telah dehidrasi dan formulanya kini menjadi mcl2· 2h2Sama ada. Apa yang berlaku pada octahedron anterior? Tiada, kecuali bahawa kedua -dua h molekul2Atau bahawa mereka ditinggalkan digantikan oleh dua cl-.
Pada mulanya anda boleh memberikan kesan yang salah bahawa terdapat empat cl- untuk setiap Mn2+; Walau bagaimanapun, separuh daripada octahedron (paksi) sebenarnya unit berulang kaca.
Oleh itu, memang benar ada MN2+ diselaraskan pada dua cl- dan dua molekul air dalam kedudukan trans. Tetapi bagi unit ini berinteraksi dengan yang lain, ia memerlukan dua jambatan CL, yang seterusnya membolehkan octahedron koordinasi untuk mangan selesai.
Boleh melayani anda: elemen diatomikSebagai tambahan kepada jambatan CL, molekul air juga bekerjasama dengan jambatan hidrogen mereka sehingga rantai MNCL ini2· 2h2Atau jangan melucutkan senjata.
Anhydrous
Akhirnya, magnesium klorida telah selesai kehilangan semua air yang terkandung dalam kristalnya; Anda mempunyai garam anhydra sekarang, mcl2. Tanpa molekul air, kristal dengan ketara kehilangan keamatan warna merah jambu mereka. Octahedron, seperti hidrat, tetap tidak berubah oleh sifat mangan itu sendiri.
Tanpa molekul air, MN2+ Hujung dikelilingi oleh octahedron yang terdiri daripada CL-. Pautan koordinasi ini mempunyai watak kovalen dan ionik; Atas sebab ini ia biasanya merujuk kepada struktur MNCL2 seperti kristal polimer. Di dalamnya terdapat lapisan alternatif Mn dan Cl.
Nomenclature
Mangan mempunyai banyak keadaan pengoksidaan yang mungkin. Kerana itu, tatanama tradisional untuk MNCL2 Ia tidak dijelaskan.
Sebaliknya, mangan klorida sepadan dengan nama yang paling terkenal, yang mana ia tidak akan menambah '(ii)' supaya ia mengikut stok tatanama: mangan klorida (II). Dan Asçi, adalah tatanama yang sistematik: Mangan dichloride.
Aplikasi
Makmal
Mangan klorida berfungsi sebagai pemangkin untuk pengklorinan sebatian organik.
Industri
Mangan klorida digunakan sebagai bahan mentah untuk penjelasan anti -partisasi untuk petrol; bahan kimpalan untuk logam bukan ferus; perantara dalam penjelasan pigmen; Dan minuman minyak Linaza.
Ia digunakan dalam industri tekstil untuk mencetak dan dicelup; Dalam pengeluaran beberapa garam mangan, termasuk tricarbonil methylciclopentadienilmanganese yang digunakan sebagai pewarna bata; dan dalam pengeluaran bateri elektrik kering.
Mangan klorida digunakan sebagai agen aloi dan ditambah kepada magnesium cair untuk menghasilkan aloi mangan-magnesium; sebagai perantara dalam penyediaan agen pengeringan untuk lukisan dan varnis; dan sebagai komponen pembasmi kuman.
Boleh melayani anda: Natrium hidroksida (NaOH): Struktur, sifat, kegunaan, sintesisIa juga digunakan dalam pembersihan magnesium.
Baja dan makanan haiwan
Mangan klorida digunakan sebagai sumber mangan, elemen, yang, walaupun bukan unsur pemakanan utama untuk tumbuh -tumbuhan seperti nitrogen, fosforus dan kalium, digunakan dalam banyak reaksi biokimia makhluk hidup ini makhluk hidup ini.
Ia juga menambah makanan haiwan pembiakan untuk pembekalan mangan, oligoemen penting untuk pertumbuhan haiwan.
Mangan klorida adalah komponen pemakanan yang membekalkan mangan, elemen yang campur tangan dalam pelbagai proses yang diperlukan untuk kehidupan, termasuk: sintesis asid lemak dan hormon seks; Asimilasi Vitamin E; pengeluaran tulang rawan; dan lain-lain.
Risiko
Ia boleh dihasilkan dengan bersentuhan dengan kemerahan kulit, kerengsaan dan dermatitis pendedahan yang berpanjangan. Mangan klorida menyebabkan kemerahan, sakit dan air mata.
Dengan menghirup penyebab garam, sakit tekak dan kekurangan nafas. Sebaliknya, pengambilan boleh berlaku muntah, loya dan cirit -birit.
Penyedutan kronik yang berlebihan terhadap garam ini boleh menyebabkan keradangan paru -paru dan penyakit reaktif berikutnya di saluran udara.
Pengambilan yang berlebihan boleh menyebabkan gangguan mental, dehidrasi, hipotensi, kegagalan hati dan buah pinggang, kegagalan sistem multiorgan dan kematian.
Neurotoxicity adalah manifestasi awal tindakan mangan yang tidak diingini, dapat mengemukakan sakit kepala, pening, kehilangan ingatan, hiperreflexia, dan gegaran ringan.
Ketoksikan yang teruk ditunjukkan oleh gejala dan tanda -tanda yang serupa dengan yang diperhatikan dalam penyakit Parkinson.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Mangan (ii) klorida. Diperoleh dari: dalam.Wikipedia.org
- Sky Spring Nanomaterials. (2016). Serbuk mangan klorida. Pulih dari: ssnano.com
- Buku Kimia. (2017). Mangan klorida. Pulih dari: buku kimia.com
- Rangkaian data toksikologi. (s.F.). Mangan klorida. Toxnet. Pulih dari: toksnet.NLM.NIH.Gov
- Gérard Cahiez. (2001). Mangan (ii) klorida. doi.org/10.1002/047084289X.RM020
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Mangan dichloride. Pangkalan data PUBCHEM. CID = 24480. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- WebConsultas Healthcare, s.Ke. (2019). Mineral: Mangan. Pulih dari: konsultasi web.com

