Struktur zink klorida (ZnCL2), sifat, mendapatkan, menggunakan

- 3490
- 288
- Clarence Greenholt DDS
Dia zink klorida Ia adalah sebatian bukan organik yang dibentuk oleh unsur zink atau zink (Zn) dan klorin (CL). Formula kimianya adalah ZnCl2. CINC ditemui dalam keadaan pengoksidaan +2 dan klorin mempunyai valencia -1.
Ia adalah pepejal kristal yang tidak berwarna atau putih. Ia sangat larut dalam air dan mudah menyerapnya dari alam sekitar, yang dapat dilihat dalam angka pepejal yang dibasahkan ditunjukkan di bawah.
 Fifcl Chloride2 pepejal agak terhidrasi. Pengguna: walkerma / domain awam. Sumber: Wikimedia Commons.
Fifcl Chloride2 pepejal agak terhidrasi. Pengguna: walkerma / domain awam. Sumber: Wikimedia Commons. Zink sebatian ini secara biologi sangat penting untuk manusia, haiwan dan tumbuh -tumbuhan, kerana ia campur tangan dalam fungsi asas seperti protein dan sintesis lemak.
Atas sebab ini ZnCl2 Ia digunakan sebagai pelengkap pemakanan kepada haiwan dan manusia dalam kes kekurangan zink, dan sebagai mikronutrien untuk tumbuh -tumbuhan.
Ia mempunyai sifat bakterostatik dan astringen, dan digunakan secara meluas untuk tujuan ini dalam ubat manusia dan veterinar. Juga menghapuskan perosak seperti kulat luar dan perantara untuk mendapatkan racun perosak.
Antara kegunaannya yang banyak berfungsi untuk merawat serat selulosa dan bulu dalam pelbagai proses, serta menyediakannya untuk warna atau percetakan. Juga melambatkan pembakaran kayu.
[TOC]
Struktur
ZnCl2 Ia adalah sebatian ionik yang dibentuk oleh Zn Cation2+ dan dua anion klorida cl- yang mengikat melalui kuasa elektrostatik.
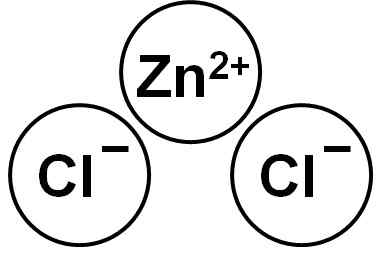 Zink klorida. Pengarang: Marilú Stea.
Zink klorida. Pengarang: Marilú Stea. Ion zink (ii) mempunyai struktur elektronik berikut:
1s2, 2s2 2 p6, 3s2 3p6 3d10, 4s0,
di mana diperhatikan bahawa kedua -dua elektron tanjung 4s, di mana konfigurasi stabil.
Ion klorida membentangkan struktur berikut:
1s2, 2s2, 2 p6, 3s2 3p6,
yang juga sangat stabil kerana mempunyai orbital lengkap.
Dalam angka itu, cara di mana ion boleh didapati di kaca boleh diperhatikan. Sfera kelabu mewakili sfera zink dan hijau ke klorin.
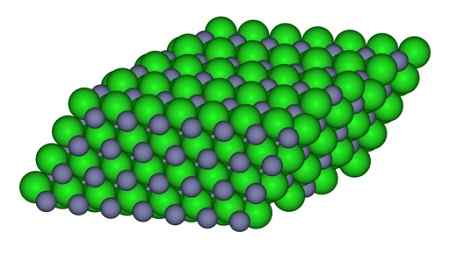 Struktur yang membentuk ion dalam kristal ZnCl2. CCOIL/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons.
Struktur yang membentuk ion dalam kristal ZnCl2. CCOIL/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons. Nomenclature
- Zink klorida (ii)
- Zink diklorida
Sifat
Keadaan fizikal
Putih pepejal atau kristal tanpa warna. Kristal heksagon.
Berat molekul
136.3 g/mol
Takat lebur
290 ºC
Takat didih
732 ºC
Ketumpatan
2,907 g/cm3 pada 25 ° C
Kelarutan
Sangat larut dalam air: 432 g/100 g h2Atau pada 25 ° C, 614 g/100 g h2Atau 100 ° C. Sangat larut dalam asid hidroklorik (HCl), alkohol dan gliserol. Benar -benar lisung.
Boleh melayani anda: Mercury hidroksida: struktur, sifat, kegunaan, risikoPh
Penyelesaian berairnya berasid. Penyelesaian 6 mol ZnCl2/Saya mempunyai pH 1.0.
Sifat kimia
Ia adalah sebatian hygroscopic dan delicoscent, kerana bersentuhan dengan kelembapan persekitaran yang menyerap banyak air. Di dalam air ia dihidrolisiskan dan mempunyai kecenderungan untuk membentuk asas tidak larut zink oxychloride.
Bertindak balas dengan zink oksida (ZnO) dalam air menjana zink oxychlorides yang membentuk bahan simen yang sangat keras.
Ia perlahan -lahan menghakis ke arah logam.
Ia tidak mudah terbakar.
Peranan biologi
Zink secara biologi adalah salah satu elemen yang paling penting. Ia telah diiktiraf sebagai penting untuk semua cara hidup.
Di dalam tubuh manusia zncl2 Zn menyediakan, yang penting untuk sintesis protein, kolesterol dan lemak. Terutamanya CINC adalah penting untuk berfungsi dengan baik sistem imun.
 ZNCL ZNCL2 Penting untuk pembahagian sel dalam makhluk hidup. Ladyofhats / domain awam. Sumber: Wikimedia Commons.
ZNCL ZNCL2 Penting untuk pembahagian sel dalam makhluk hidup. Ladyofhats / domain awam. Sumber: Wikimedia Commons. Lebih daripada 25 protein yang mengandungi zink telah dikenalpasti, dan kebanyakannya adalah enzim, yang diperlukan dalam pembahagian sel dan pertumbuhan, dan untuk pembebasan vitamin A dari hati.
Kekurangan CINC boleh menyebabkan pertumbuhan pertumbuhan, fungsi mental yang tertekan, anoreksia, dermatitis, penurunan imuniti, cirit -birit dan penglihatan malam yang lemah, antara keadaan lain.
Memperoleh
Secara komersil sebatian ini disediakan dengan bertindak balas asid hidroklorik berair dengan sekerap, sisa zink atau dengan mineral yang mengandunginya. Dalam tindak balas ini terdapat juga hidrogen gas (h2).
Merawat zink dengan hidrogen klorida pada 700 ° C diperolehi.
Zn + Hcl → ZnCl2 + H2↑
Aplikasi
Dalam rawatan terapeutik
Ia adalah antibakteria yang lembut atau bakteria, jadi ia digunakan dalam pancuran vagina untuk menghapuskan jangkitan tricomonas atau haemophilus. Ia juga berfungsi untuk merawat calluses, sebagai astringen dan di chemiocirugia dalam kanser kulit.
Ia digunakan sebagai astringen dalam beberapa kosmetik seperti losyen yang menyegarkan untuk kulit.
Sebagai suplemen pemakanan
Kerana kepentingannya dalam pelbagai fungsi organisma manusia, ZnCl2 Ia diberikan secara lisan sebagai sebahagian daripada aksesori pemakanan dan juga pada orang yang memerlukan makanan parenteral.
Suplemen ZnCl2 Mereka dibekalkan untuk merawat zon.
Boleh melayani anda: campuran homogen Suplemen ZnCl2 Mereka harus digunakan apabila ada kekurangan zink. Pengarang: Moakets. Sumber: Pixabay.
Suplemen ZnCl2 Mereka harus digunakan apabila ada kekurangan zink. Pengarang: Moakets. Sumber: Pixabay. Individu yang sihat memperolehnya melalui makanan.
Ia harus dibekalkan sekurang -kurangnya 1 jam sebelum makan atau 2 jam selepas ini, kerana beberapa makanan dapat menghalang penyerapan mereka. Pada pesakit yang mengalami kerengsaan perut selepas pengambilan tambahan harus menelannya dengan makanan, tetapi dengan cara ini zink akan kurang biodispononable.
Dalam aplikasi veterinar
Penyelesaiannya telah digunakan pada haiwan sebagai agen kaustik untuk membakar atau fistula caulbody, yang merupakan hubungan antara organ yang tidak normal atau sihat; Dalam bentuk pasta berfungsi untuk merawat ulser dan kemoterapi kanser.
 Penyelesaian zncl berair2 Mereka digunakan untuk merawat jangkitan mata haiwan. Pengarang: Mabel Amber. Sumber: Pixabay.
Penyelesaian zncl berair2 Mereka digunakan untuk merawat jangkitan mata haiwan. Pengarang: Mabel Amber. Sumber: Pixabay. Dalam jangkitan mata, penyelesaian yang sangat dicairkan dari sebatian ini bertindak sebagai antiseptik dan astringen.
Ia juga digunakan sebagai jejak makanan haiwan atau sebagai makanan tambahan.
Dalam simen khas
Tindak balas antara ZnCl2 Dan Zno di dalam air menghasilkan beberapa zink oxychloride yang membentuk bahan yang sangat keras atau simen. Unsur -unsur utama adalah 4zno • zncl2• 5h2O dan zno • zncl2• 2h2Sama ada.
Jenis simen ini menentang serangan asid atau air mendidih. Walau bagaimanapun, pentahydrate sangat stabil dan tidak larut tetapi tidak berubah, dan dihydrate lebih larut dan boleh menyebabkan saliran cecair.
Atas sebab -sebab ini simen ini mempunyai sedikit aplikasi.
Sebagai pemangkin
Ia berfungsi untuk mempercepatkan beberapa tindak balas kimia organik. Bertindak sebagai ejen pemeluwap. Sebagai contoh, dalam tindak balas aldolic, tindak balas aminasi dan tindak balas tambahan kitaran. Dalam beberapa tindakan ini sebagai pemula radikal.
Ia adalah asid Lewis dan memangkinkan tindak balas Diels-Alder. Ia juga digunakan sebagai pemangkin dalam reaksi Friedel-Crafts, untuk mengeluarkan pewarna dan pewarna, dan dalam pembuatan resin poliester-politik.
Berikut adalah tindak balas di mana kompaun ini campur tangan:
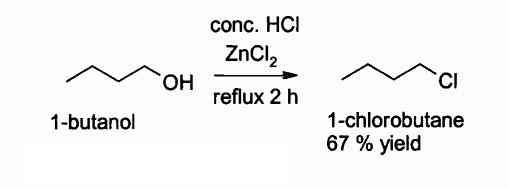 Reaksi mendapatkan alkil klorida menggunakan ZnCl2. Pengarang: Walkerma. Sumber: Wikimedia Commons.
Reaksi mendapatkan alkil klorida menggunakan ZnCl2. Pengarang: Walkerma. Sumber: Wikimedia Commons. Dalam aktiviti pertanian
Ia telah digunakan sebagai herbisida dalam tanaman, sebagai rawatan foliar, untuk menghapuskan perosak seperti kulat dan lumut, dan sebagai mikronutrien. Adalah perantara untuk menyediakan racun perosak.
Dalam aplikasi pergigian
Ia digunakan dalam mencuci mulut, namun masa hubungan yang disyorkan sangat pendek, jadi ia hanya bertindak sebagai astringen dalam mukosa lisan. Ia berfungsi sebagai desensitizer, ia digunakan dalam pasta gigi dan merupakan sebahagian daripada simen pergigian.
Boleh melayani anda: natrium klorit (NaClo2): struktur, sifat, kegunaan, risikoDalam industri tekstil dan kertas
Ia adalah ramuan pelarut yang digunakan dalam pembuatan rayon atau sutera buatan dari selulosa. Ia adalah ejen retikulasi atau kesatuan untuk resin yang ditamatkan pada tekstil. Ia juga berfungsi untuk merawat mereka dan memihak kepada pemuliharaan mereka.
Ia membolehkan kain curl, gentian sutera dan bulu yang berasingan, dan bertindak sebagai mordan dalam percetakan dan pewarna tekstil.
Ia digunakan dalam pembuatan skrol kertas dan menghasilkan kertas krep.
Dalam penyediaan nanopartikel
Dengan bertindak balas zink klorida dengan natrium sulfida (NA2S) melalui kaedah sonokimia dan dengan kehadiran sebatian organik tertentu nanopartikel zink sulfida (ZnS) diperolehi. Kaedah sonokimia menggunakan gelombang bunyi untuk menyebabkan reaksi kimia.
Nanomaterials jenis ini boleh mempunyai aplikasi sebagai agen photocatalytic untuk menghasilkan, contohnya, pembahagian air dalam komponennya (hidrogen dan oksigen) dengan tindakan cahaya.
Dalam beberapa aplikasi
- Deodoran, antiseptik dan disinfektan kawasan. Kawalan lumut, acuan dan kulat di struktur dan kawasan bersebelahan luaran seperti trotoar, halaman dan pagar. Pembasmian kuman, kencing, permaidani dan kayu termampat.
- Digunakan dalam campuran untuk embalmar dan penyelesaian untuk pemuliharaan spesimen anatomi.
- Retarder api kayu.
- Bahan utama dalam pam asap yang digunakan untuk menyebarkan pelbagai orang; Pemadam kebakaran menggunakannya dalam latihan dan amalan api api.
 Cinc Chloride digunakan dalam pam asap yang digunakan dalam latihan ketenteraan. Atau.S. PHOTOSCPL semasa Pertahanan. Abraham Lopez / Bahagian Marin ke -2 / Domain Awam. Sumber: Wikimedia Commons.
Cinc Chloride digunakan dalam pam asap yang digunakan dalam latihan ketenteraan. Atau.S. PHOTOSCPL semasa Pertahanan. Abraham Lopez / Bahagian Marin ke -2 / Domain Awam. Sumber: Wikimedia Commons. - Komponen aliran kimpalan. Dalam rakaman logam. Untuk pewarna keluli, komponen bilik mandi venir besi dan besi dengan tembaga.
- Dalam simen simen magnesium dan logam.
- Untuk memecahkan emulsi dalam penapisan minyak. Ejen dalam pembuatan asfalt.
- Elektrolit dalam bateri kering.
 Bateri ZnCl kering2. Pengguna: 32bitmaschine; Disunting oleh pengguna Jaybear/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons.
Bateri ZnCl kering2. Pengguna: 32bitmaschine; Disunting oleh pengguna Jaybear/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons. - Pengalihan getah.
- Ejen dehidrasi.
Risiko
Ia boleh menyebabkan luka bakar ke mata, kulit dan membran mukus.
Apabila dipanaskan pada penguraiannya memancarkan toksik hidrogen klorida (HCl) dan zink oksida (ZnO).
Amaran mengenai penggunaannya sebagai ubat
Walaupun kajian konklusif hilang, dianggarkan bahawa jika sebatian ini diberikan kepada wanita hamil, ia boleh menyebabkan kerosakan pada janin. Tetapi manfaat yang berpotensi boleh mempunyai lebih banyak berat badan daripada kemungkinan risiko.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Zink klorida. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Liska, m. et al. (2019). Simen khas. Zink Oxychloride Cement. Dalam Kimia Simen dan Konkrit Lea (Edisi Kelima). Pulih dari Scientedirect.
- Pohanish, r.P. (2017). Zink klorida. Dalam Buku Panduan Bahan Kimia dan Karsinagen Beracun Sittig (Edisi Ketujuh). Pulih dari Scientedirect.com.
- Gedanken, a. dan Perelshtein, i. (2015). Ultrasound kuasa untuk pengeluaran nanomaterials. Dalam ultrasonik kuasa. Pulih dari Scientedirect.
- Archibald, s.J. (2003). Kumpulan Logam Peralihan 9-12. Reaksi dan pemangkinan. Dalam Memahami Kimia Penyelarasan II. Pulih dari Scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Memimpin, d.R. (Editor) (2003). Buku Panduan Kimia dan Fizik CRC. 85th CRC Press.
- « Struktur kromat zink, sifat, mendapatkan, menggunakan
- Struktur nitrat zink, sifat, mendapatkan, menggunakan »

