Struktur kromat zink, sifat, mendapatkan, menggunakan

- 1726
- 517
- Julius Dibbert
Dia Zink Chromate O CINC Chromate adalah sebatian bukan organik yang dibentuk oleh unsur zink (Zn), krom (Cr) dan oksigen (O) (O). Ia mempunyai ion Zn2+ dan CRO42-. Formula kimianya adalah zncro4.
Istilah 'kromat zink' berkhidmat secara komersil untuk menetapkan tiga sebatian dengan struktur molekul yang berbeza: (a) kromat zink yang betul zncro4, (b) Kromat asas Fifcro4• 4ZN (OH)2, dan (c) kromat asas zink dan 3zncro kalium4• Zn (oh)2• k2Cro4• 2h2Sama ada.
 Struktur kromat zink. Pengarang: Marilú Stea.
Struktur kromat zink. Pengarang: Marilú Stea. Ia digunakan terutamanya dalam lukisan atau dana yang melindungi logam kakisan. Untuk melakukan ini, ia bercampur dengan lukisan, varnis dan polimer yang kemudiannya digunakan di permukaan logam.
Ia juga digunakan dalam kemasan hiasan dan pelindung yang dicapai dengan kromat dan asid lain yang melapisi pelbagai objek seperti alat. Ia juga berfungsi untuk mengekalkan kekonduksian elektrik bahagian logam.
Ia digunakan sebagai pemangkin dalam tindak balas hidrogenasi (penambahan hidrogen) dalam sebatian organik. Ia adalah sebahagian daripada pigmen yang dahulu digunakan dalam lukisan artistik.
Ia adalah bahan yang menghasilkan kanser dan ini kerana kromat mempunyai krom dalam keadaan pengoksidaan +6.
[TOC]
Struktur
 Zincro's Chromate4 Ia adalah sebatian kuning. Pengarang: Marilú Stea.
Zincro's Chromate4 Ia adalah sebatian kuning. Pengarang: Marilú Stea. Kromat zink adalah sebatian ionik yang dibentuk oleh zn kation lima belas2+ dan anion cromato42-. Yang terakhir dibentuk oleh Chrome dengan Valencia +6 (Chrome Hexavalent, CR6+) dan empat atom oksigen dengan keadaan pengoksidaan -2.
Zn ion2+ Ia mempunyai struktur elektronik berikut:
1s2, 2s2 2 p6, 3s2 3p6 3d10.
Bagi bahagiannya, Chrome Hexavalent mempunyai orbital elektroniknya dengan penyesuaian berikut:
1s2, 2s2 2 p6, 3s2 3p6.
Kedua -dua struktur sangat stabil kerana orbital selesai.
Nomenclature
- Zink Chromate
- Garam zink asid kromik
- Zink kuning (walaupun dengan istilah ini sebatian lain yang mengandungi zncro juga dipanggil4).
Sifat
Keadaan fizikal
Pepejal kristal kuning lemon kuning. Prisms -bentuk kristal.
Berat molekul
181.4 g/mol
Takat lebur
316 ºC
Ketumpatan
3.40 g/cm3
Kelarutan
Air larut dalam air: 3.08 g/100 g h2Sama ada. Ia mudah dibubarkan dalam asid dan ammonia cecair. Tidak larut dalam aseton.
Dapat melayani anda: tetap pengionanPh
Menurut beberapa sumber, penyelesaian berair mereka berasid.
Sifat kimia
Ia adalah sebatian pengoksidaan yang kuat, jadi ia dapat bertindak balas dengan mengurangkan ejen yang menghasilkan haba. Antara bahan yang boleh bertindak balas organik, seperti sianida, ester dan tiocianates. Anda juga boleh menyerang beberapa logam.
Dalam larutan akueus ion kromat membentangkan pelbagai baki bergantung kepada pH dan membentuk spesies yang berbeza.
Spesies yang dibentuk oleh kromat
Di atas pH 6 hadir ion cromato42- (kuning); Antara pH 2 dan pH 6 adalah ion HCRO dalam keseimbangan4- dan CR dikromat2Sama ada72- (oren merah); Pada pH kurang daripada 1 spesies utama ialah h2Cro4.
Apabila zink (ii) kation ditambah kepada penyelesaian berair ini, zncro precipitates4.
Baki adalah seperti berikut:
Hcro4- ⇔ cro42- + H+
H2Cro4 ⇔ Hcro4- + H+
Cr2Sama ada72- + H2Atau ⇔ 2 hcro4-
Dalam medium asas, berikut berlaku:
Cr2Sama ada72- + Oh- ⇔ Hcro4- + Cro42-
Hcro4- + Oh- ⇔ cro42- + H2Sama ada
Zncro4 Ia tidak bertindak balas dengan cepat dengan udara atau air.
Memperoleh
Ia boleh dihasilkan dengan bertindak balas lumpur zink oksida atau hidroksida berair dengan garam kromat yang dibubarkan dan kemudian meneutralkan.
Secara industri, proses Cronak digunakan, di mana kabus logam direndam dalam larutan natrium dichromate (NA2Cr2Sama ada7) dan asid sulfurik (h2SW4).
Ia juga boleh disediakan dengan mencetuskannya dari penyelesaian di mana terdapat zink dan garam kromat yang dibubarkan:
K2Cro4 + Znso4 → Zncro4↓ + k2SW4
Aplikasi
Dalam perlindungan logam
Dalam industri metalurgi, ia digunakan terutamanya dalam lukisan latar belakang (cat persediaan atau salutan awal) yang digunakan untuk logam, yang mana ia memberikan rintangan kakisan.
Ia digunakan sebagai pigmen dalam lukisan dan varnis, dimasukkan dalam matriks polimer organik.
Cat jenis ini diberikan kepada paip, tangki minyak, struktur keluli seperti jambatan, menara penghantaran kuasa elektrik dan bahagian kereta untuk menghalang kakisan.
 Struktur keluli jambatan dicat dengan asas kromat zink sebelum cat terakhir untuk melindungi mereka dari kakisan. Pengarang: オギクボ マンサク. Sumber: Pixabay.
Struktur keluli jambatan dicat dengan asas kromat zink sebelum cat terakhir untuk melindungi mereka dari kakisan. Pengarang: オギクボ マンサク. Sumber: Pixabay. Passivation
Ia juga melindungi komponen logam yang ditutup dengan zink yang telah diluluskan menggunakan kromat logam alkali. Passivation terdiri daripada kehilangan kereaktifan kimia di bawah keadaan persekitaran tertentu.
Boleh melayani anda: sel elektrokimiaLapisan ini juga berfungsi sebagai kemasan hiasan dan mengekalkan kekonduksian elektrik. Mereka biasanya digunakan untuk artikel harian seperti alat dan boleh diiktiraf oleh warna kuning mereka.
 Beberapa alat ditutup dengan kromat zink. Pengarang: Duk. Sumber: Wikimedia Commons.
Beberapa alat ditutup dengan kromat zink. Pengarang: Duk. Sumber: Wikimedia Commons. Bagaimanakah ia berfungsi
Penyiasat tertentu mendapati bahawa perlindungan terhadap kakisan logam yang dijalankan oleh fi -chromate mungkin disebabkan oleh fakta bahawa ia menghalang pertumbuhan kulat. Dengan cara ini kemerosotan salutan cat anti -korosif.
Kajian -kajian lain menunjukkan bahawa kesan antikorrosif mungkin kerana sebatian mempercepat pembentukan oksida pelindung pada logam.
 Latar belakang anticorrosif zink kromat untuk perlindungan permukaan logam. 水水/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons.
Latar belakang anticorrosif zink kromat untuk perlindungan permukaan logam. 水水/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons. Reaksi Catalysis
Kompaun ini telah digunakan sebagai pemangkin dalam pelbagai tindak balas kimia, seperti hidrogenasi karbon monoksida (CO) untuk mendapatkan metanol (CH3Oh).
Esters boleh ditukar kepada alkohol utama dengan hidrogenasi, menggunakan sebatian ini untuk mempercepat reaksi.
Menurut beberapa penyelidik, tindakan pemangkinnya adalah disebabkan oleh fakta bahawa pepejal tidak menunjukkan struktur stoikiometrik, iaitu, ia menyimpang dari formula Zncro yang4 Dan sebaliknya:
Zn1-xCr2-xSama ada4
Yang menunjukkan bahawa terdapat kecacatan dalam struktur yang memihak kepada pemangkinan.
Aplikasi lain
Ia ditemui di beberapa pewarna berminyak, ia berfungsi untuk mencetak, ia adalah ejen untuk rawatan permukaan, ia digunakan di lantai lantai dan merupakan reagen di makmal kimia.
Kegunaan dihentikan
Sejak tahun 1940 -an, derivatif zncro digunakan4, Zink dan kromat tembaga, sebagai fungisida foliar untuk tanaman kentang.
 Tumbuhan Paus. Pengarang: Dirk (Beeki®) Schumacher. Sumber: Pixabay.
Tumbuhan Paus. Pengarang: Dirk (Beeki®) Schumacher. Sumber: Pixabay. Penggunaan ini telah ditinggalkan oleh ketoksikan dan kesan berbahaya dari kompaun.
Dalam lukisan artistik abad kesembilan belas, kehadiran garam kromat zink kompleks telah dijumpai, 4zncro4• k2Atau • 3h2O (zink kromat dan kalium terhidrat), yang merupakan pigmen kuning yang dipanggil lemon kuning.
Boleh melayani anda: lithium chloride (LICL): sifat, risiko dan kegunaanRisiko
Walaupun ia bukan bahan bakar, apabila dipanaskan ia memancarkan gas toksik. Boleh meletup jika anda bersentuhan dengan pengurangan ejen atau bahan organik.
Habuk menjengkelkan mata dan kulit yang menghasilkan reaksi alahan. Penyedutannya menyebabkan kerengsaan hidung dan tekak. Ia menjejaskan paru -paru, menyebabkan pemendekan, bronkitis, radang paru -paru dan asma.
Pengambilannya mempengaruhi saluran pencernaan, hati, buah pinggang, sistem saraf pusat, menghasilkan keruntuhan peredaran darah dan merosakkan sistem imun.
Penjana kanser
Ia adalah karsinogen yang disahkan, meningkatkan risiko kanser paru -paru dan rongga hidung. Ia beracun untuk sel (sitotoksik) dan juga merosakkan kromosom (genotoksik).
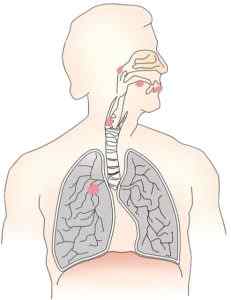 Kromat zink menghasilkan kanser paru -paru dan saluran udara. Pengarang: OpenClipart-Vectors. Sumber: Pixabay.
Kromat zink menghasilkan kanser paru -paru dan saluran udara. Pengarang: OpenClipart-Vectors. Sumber: Pixabay. Telah ditentukan bahawa ketoksikan dan karsinogenik sebatian ini disebabkan oleh tindakan krom dalam pengoksidaan +6. Walau bagaimanapun, kehadiran CINC memberikan ketidaksuburan kepada produk dan ini juga mempengaruhi kerosakan yang dihasilkannya.
Kesan ke atas persekitaran
Ia sangat toksik kepada haiwan dan untuk kehidupan akuatik, menyebabkan kesan berbahaya yang terakhir dari masa ke masa. Ahli kimia ini boleh menjadi bioakumulasi di seluruh rantaian makanan.
Atas semua sebab ini, proses yang melibatkan kromat (hexavalent chrome) dikawal oleh organisasi kesihatan dunia dan digantikan dengan teknik alternatif tanpa ion ini.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Zink Chromate. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Memimpin, d.R. (Editor) (2003). Buku Panduan Kimia dan Fizik CRC. 85th CRC Press.
- Xie, h. et al. (2009). Zink kromat indut ketidakstabilan kromosom dan DNA Doble Strad pecah di sel LUN manusia. Toxicol Appl Pharmacol 2009 Feb 1; 234 (3): 293-299. NCBI pulih.NLM.NIH.Gov.
- Jackson, r.Ke. et al. (1991). Aktiviti pemangkin dan struktur kecacatan kromat zink. Catal Lett 8, 385-389 (1991). Pautan pulih.Springer.com.
- Yahalom, J. (2001). Kaedah perlindungan kakisan. Dalam Ensiklopedia Bahan: Sains dan Teknologi. Pulih dari Scientedirect.com.
- Stranger-Johannessen, m. (1988). Kesan antimikrob pigmen dalam cat pelindung kakisan. Di Houchton d.R., Eggins, h.Sama ada.W. (eds) Biodeterioration 7. Pautan pulih.Springer.com.
- Barrett, a.G.M. (1991). Pengurangan. Dalam memahami sintesis organik. Pulih dari Scientedirect.com.
- Khamis, h.W. et al. (1948). Kromat sebagai kulat kentang. American Potato Journal 25, 406-409 (1948). Pautan pulih.Springer.com.
- Lynch, r.F. (2001). Zink: Pengecualian, pemprosesan termokimia, sifat, dan aplikasi. Dalam Ensiklopedia Bahan: Sains dan Teknologi. Pulih dari Scientedirect.com.
- Ramesh Kumar, a.V. dan nigam, r.K. (1998). Kajian Spektroskopi Mössbauer mengenai produk kakisan di bawah salutan pertama yang mengandungi pigmen anticorrosif. J Radioanal Nucl Chem 227, 3-7 (1998). Pautan pulih.Springer.com.
- Otero, v. et al. (2017). Barium, Zink dan Stontium Yellows pada akhir lukisan minyak abad ke-20 ke-20. Herit Sci 5, 46 (2017). Pulih dari HeritagesCienceJournal.Springeropen.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Wikipedia (2020). Zink Chromate. Diambil dari.Wikipedia.org.
- Wikipedia (2020). Salutan penukaran kromat. Diambil dari.Wikipedia.org.
- « Tali Tali Pasifik, Ciri -ciri, Gunung Berapi Utama
- Struktur zink klorida (ZnCL2), sifat, mendapatkan, menggunakan »

