Kepekatan peratusan

- 3394
- 473
- Horace Gulgowski
Berapakah kepekatan peratusan?
The kepekatan peratusan Ini adalah cara untuk menyatakan hubungan larut dalam seratus bahagian pencampuran atau penyelesaian. Harus diperhatikan bahawa "bahagian" ini dapat dinyatakan dalam unit jisim atau kelantangan. Terima kasih kepada kepekatan ini, komposisi penyelesaian diketahui, yang, tidak seperti sebatian tulen, tidak tetap.
Bukan sahaja komposisinya berbeza -beza, tetapi juga sifat organoleptiknya. Balang teh imej yang lebih rendah memperoleh rasa yang lebih sengit (dan pewarnaan) kerana lebih banyak rempah dibubarkan di dalam air ais. Walau bagaimanapun, walaupun sifat mereka berubah, kepekatan rempah -rempah ini tetap berterusan.

Sekiranya kita mengandaikan bahawa 100 gram ini dibubarkan di dalam air dan kemudian diaduk cukup untuk homogenisasi penyelesaian, gram akan diedarkan di seluruh balang. Peratusan kepekatan teh tetap tetap walaupun kandungan cecair dibahagikan kepada bekas yang berbeza.
Ini hanya akan berubah jika lebih banyak air ditambah ke balang, yang, walaupun ia tidak mengubah suai jisim asal rempah terlarut (larut), mengubah suai kepekatannya. Untuk contoh kadar teh, kepekatan ini dapat dinyatakan dengan mudah dalam jisim larut antara jumlah air.
Oleh itu, kes -kes yang tidak terhingga di mana pengiraan kepekatan ini memainkan peranan penting.
Apa itu penyelesaian?
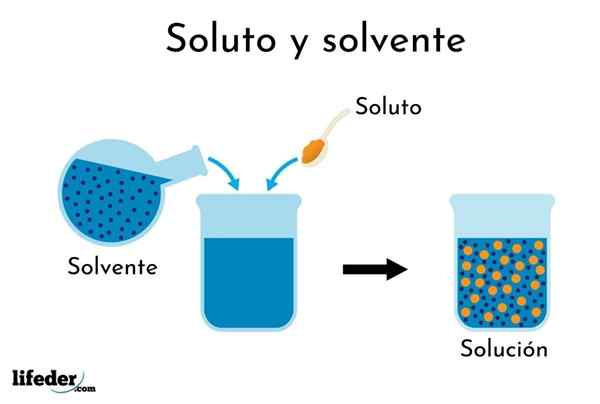 Larut larut dalam pelarut
Larut larut dalam pelarut Pemahaman istilah "penyelesaian" diperlukan sebelum menangani peratusan ekspresi kepekatannya.
Penyelesaian adalah campuran homogen atau seragam dua atau lebih bahan yang zarahnya adalah saiz atom atau molekul.
Ia dapat melayani anda: apakah kesan negatif yang kita ada dengan kelarutan air?Komponen ini adalah pelarut dan pelarut. Larut adalah bahan yang dibubarkan dalam larutan, yang berada dalam perkadaran yang lebih rendah. Pelarut adalah cara penyebaran dalam larutan dan berada dalam perkadaran yang lebih besar (seperti air dalam balang teh).
Ciri -ciri kepekatan peratusan
- Kepekatan peratusan membentangkan keselesaan mengelakkan pengiraan molariti dan unit tumpuan lain. Dalam banyak kes, sudah cukup untuk mengetahui jumlah larutan yang dibubarkan dalam penyelesaiannya. Walau bagaimanapun, untuk tindak balas kimia, ia meninggalkan sisi oleh kepekatan molar.
- Memudahkan pengesahan undang -undang pemuliharaan massa.
- Ia dinyatakan dalam bahagian per ratus penyelesaian, di mana larutan dikira.
- Hubungan antara larutan dan larutan dapat dinyatakan dalam unit massa (gram) atau kelantangan (mililiter).
Bagaimana ia dikira?
Cara untuk mengira ia bergantung pada unit di mana anda ingin menyatakannya. Walau bagaimanapun, pengiraan matematik pada dasarnya sama.
Kedua -dua peratus berat mengikut berat % m/m
% (m / m) = (gram larutan / gram larutan) ∙ 100
Peratusan penyelesaian menunjukkan bilangan gram larut dalam setiap 100 gram penyelesaian.
Sebagai contoh, penyelesaian 10 % m/m NaOH mengandungi 10 gram NaOH setiap 100 gram penyelesaian. Ia juga boleh ditafsirkan dengan cara ini: 10 g NaOH dibubarkan dalam 90 g air (100-10).
Kedua -dua peratus berat dalam jumlah % m/v
% (m / v) = (gram larutan / mililiter larutan) ∙ 100
Boleh melayani anda: Sebatian Quaternary: Ciri, Latihan, ContohPeratusan dalam miligram adalah unit tumpuan yang sering digunakan dalam laporan klinikal untuk menggambarkan kepekatan yang sangat rendah dari larut (contohnya, jejak mineral dalam darah).
Sebagai kes tertentu, terdapat contoh berikut: Tahap nitrogen dalam darah seseorang adalah 32 mg%, yang bermaksud bahawa terdapat 32 mg nitrogen terlarut setiap 100 ml darah.
Kedua -dua jumlah peratus dalam jumlah % v/v
% (v / v) = (mililiter larutan / mililiter larutan) ∙ 100
Jumlah peratus dalam jumlah penyelesaian menunjukkan bilangan mililiter larut dalam setiap 100 mililiter penyelesaian.
Sebagai contoh, larutan alkohol 25%v/v di dalam air, mengandungi 25 mililiter alkohol setiap 100 mililiter larutan, atau apa yang sama: 75 ml air membubarkan 25 ml alkohol.
Contoh Peratusan Pengiraan Kepekatan
Contoh 1
Sekiranya mereka mempunyai 7 g kio3, Berapa gram penyelesaian 0.5 % m/m boleh disediakan dengan jumlah garam ini?
Penyelesaian 0.5 % m/m sangat dicairkan, dan ditafsirkan seperti berikut: untuk setiap 100 gram penyelesaian terdapat 0.5 gram kio3 dibubarkan. Oleh itu, untuk menentukan gram penyelesaian ini yang boleh disediakan, faktor penukaran digunakan:
7 g kio3 ∙ (100 g matahari/ 0.5 g kio3) = 1400 g atau 1.4 kg penyelesaian.
Bagaimana mungkin? Jelas sekali, jumlah jisim yang besar datang dari air; Oleh itu, 7 gram kio3 Mereka dibubarkan dalam 1393 gram air.
Boleh melayani anda: Batch Reactor: Ciri, Bahagian, AplikasiContoh 2
Sekiranya anda ingin menyediakan 500 gram penyelesaian CUSO4 1 %, berapa gram garam asas yang diperlukan?
Faktor penukaran digunakan untuk membersihkan g cuso4 Yang diinginkan:
500 g matahari Cuso4 ∙ (1 g cuso4/ 100 g matahari cuso4) = 5 g cuso4
Iaitu 5 g cuso dibubarkan4 (garam warna kebiruan terang) dalam 495 g air (kira -kira 495 ml)
Contoh 3
Jika 400 ml air bercampur, 37 gram gula, 18 gram garam dan 13 gram natrium sulfat (NA2SW4), Apakah kepekatan peratusan massa bagi setiap komponen campuran?
Sekiranya diandaikan bahawa ketumpatan air adalah 1g/ ml, maka campuran mempunyai 400 g air. Menambah jumlah jisim komponen penyelesaian adalah: (400 + 37 + 18 + 13) = 468 g penyelesaian.
Di sini pengiraan adalah langsung dan mudah:
%Air m/ m = (400 g air/ 468 g matahari) ∙ 100 = 85.47
%Gula m/ m = (37 g gula/ 468 g matahari) ∙ 100 = 7.90
%Garam m/ m = (18 g garam/ 468 g matahari) ∙ 100 = 3.84
%Na2SW4 m/m = (13 g na2SW4/ 468 g matahari) ∙ 100 = 2.77
Menambah semua peratusan jisim individu adalah: (85.47 + 7.90 + 3.84 + 2.77) = 99.98 % ≈ 100 %, jumlah campuran.

