Kelajuan berterusan

- 2334
- 61
- Ms. Santos Fritsch
Apakah kelajuan pemalar?
The Kelajuan berterusan Ia adalah perkadaran yang berterusan dari undang -undang kelajuan kinetik kimia, yang mewujudkan hubungan antara kepekatan molar reagen dan kelajuan reaksi.
Sebagai reagen, kelajuan reaksi dikonsumsi, juga berkurangan. Itulah sebabnya dalam pengiraan kelajuan pemalar, diwakili oleh simbol 'k', kelajuan awal diambil kira, untuk mempunyai titik perbandingan antara beberapa eksperimen.

Kinetik kimia menunjukkan bahawa pemalar ini bergantung kepada perintah tindak balas reagen, yang kepekatannya akan mengubah kelajuan reaksi. Sebaliknya, mengikut persamaan Arrhenius, k juga bergantung pada suhu dan tenaga pengaktifan untuk reaksi.
Itulah sebabnya dikatakan bahawa pemalar kelajuan bukanlah pemalar yang benar, kerana ia berbeza dengan suhu dan juga dengan kehadiran pemangkin yang mengubah suai tenaga pengaktifan. Oleh itu, tidak ada banyak jadual di mana mereka datang untuk reaksi tertentu (dan syarat).
Sebagai contoh, untuk tindak balas di mana A dan B bertindak balas, masing -masing dengan urutan tindak balas 1, pemalar dilaporkan K hingga 25 ° C, dan dengan penambahan jumlah pemangkin tertentu, ia tidak akan sama jika reaksi dibuat pada suhu 26 atau 27 ºC. Variasi yang sedikit akan menjejaskan nilai k, yang hanya malar semasa syarat -syarat yang ditetapkan untuk eksperimen.
Cara mengira kelajuan pemalar?
Percubaan
Penentuan nilai pemalar kelajuan tindak balas dibuat secara eksperimen. Jika, sebagai contoh, anda ingin menentukan nilai pemalar kelajuan untuk reaksi bentuk:
A +b → c
Untuk penubuhan nilai k, tiga tindak balas boleh dibuat, dengan perbezaan berikut: Dalam tindak balas 2 kepekatan awal reagen A adalah malar, [A], tetapi dua kali ganda, sebagai contoh, kepekatan reagen B, [[ B].
Sementara itu, dalam tindak balas 3 [A] dua kali ganda berbanding dengan tindak balas 1, menjaga malar [b].
Oleh itu, jadual kepekatan akan dibina yang akan membandingkan kelajuan awal antara beberapa eksperimen. Ini dengan tujuan menentukan pesanan tindak balas, dan berturut -turut untuk mengira kelajuan pemalar.
Boleh melayani anda: aluminium hidroksida: struktur, sifat, kegunaan, risikoPerintah tindak balas
Pengiraan pertama
Untuk tindak balas sebelumnya kelajuannya dinyatakan oleh persamaan:
Kelajuan tindak balas = k · [a]x· [B]dan
Di mana 'x' e 'dan' sesuai dengan perintah tindak balas untuk reagen a dan b, masing -masing.
Untuk menentukan nilai pesanan tindak balas, perbandingan antara tindak balas 2 dan 1, serta antara tindak balas 3 dan 1 mesti dibuat.
Apabila membandingkan tindak balas 1 dengan 2, ia dapat diperhatikan, sebagai contoh, dengan menduplikasi [b] terdapat pertindihan kelajuan tindak balas.
Kemudian: perkadaran [b] antara reaksi 2 dan 1 adalah 2, serta perkadaran antara kelajuan reaksi. Kemudian, nilai pesanan tindak balas dapat diperolehi dengan b (eksponen dan), melalui pendekatan berikut:
 Pengiraan urutan tindak balas 'dan'. Sumber: Gabriel Bolívar.
Pengiraan urutan tindak balas 'dan'. Sumber: Gabriel Bolívar. Kelajuan Eksperimen 2 adalah dua kali lebih cepat daripada kelajuan Eksperimen 1. Oleh itu, membahagikan dua persamaan di atas kita akan mempunyai:
2 = 2dan
Oleh itu, 'dan' vale 1, dapat menyimpulkan bahawa urutan reaksi berkenaan dengan reagen b adalah urutan pertama.
Pengiraan kedua
Dengan cara yang sama kita meneruskan dengan reagen A untuk pengiraan 'x':
 Pengiraan urutan tindak balas 'x'. Sumber: Gabriel Bolívar.
Pengiraan urutan tindak balas 'x'. Sumber: Gabriel Bolívar. Kelajuan Eksperimen atau Reaksi 3 adalah empat kali lebih tinggi daripada Eksperimen atau Reaksi 1. Oleh itu:
4 = 2x
Sama ada
22 = 2x
Dan nilai x adalah 2, jadi tindak balas adalah urutan kedua berhubung dengan reagen kepada.
Pembersihan Akhir
Kemudian, nilai pemalar kelajuan berdasarkan mana -mana tindak balas boleh diwujudkan:
Kelajuan tindak balas = k · [a]2· [B]
Cukup untuk memperkenalkan nilai eksperimen dan jelas k:
K = kelajuan tindak balas / ([a]2· [B])
Contoh
Contoh berikut berfungsi sebagai pengenalan sebelum latihan diselesaikan dari bahagian berikut.
Contoh 1
Dalam tindak balas kimia:
a) Jika kepekatan awal reagen dua kali ganda kelajuan tindak balas: apakah urutan reaksi berkenaan dengan reagen ini?
b) Jika kenaikan kepekatan reagen menyebabkan peningkatan kelajuan dalam faktor 8, apakah urutan reaksi maka?
c) Jika kepekatan reagen mengalami perubahan dan kelajuan tetap sama: apakah urutan reaksi berkenaan dengan reagen?
Ia boleh melayani anda: sikopropana (c3h6)Dalam a) perkadaran kelajuan tindak balas adalah sama dan perkadaran kepekatan reagen adalah sama dengan 2x,
2 = 2x
Oleh itu, x = 1 dan urutan tindak balas berkenaan dengan reagen adalah 1.
Dalam b) perkadaran kelajuan tindak balas adalah sama 8 (23) dan perkadaran kepekatan reagen adalah sama dengan 2x,
23 = 2x
Oleh itu, x = 3 dan urutan tindak balas berkenaan dengan reagen adalah 3-
Manakala dalam c) kelajuan tindak balas adalah bebas daripada kepekatan reagen, jadi urutan tindak balas berkenaan dengan reagen adalah sifar.
Contoh 2
Reaksi:
2 Tidak2 + Sama ada2 → 2 no2
Ia mempunyai ungkapan undang -undang kelajuan berikut:
Kelajuan tindak balas = k · [tidak2]2· Sama ada2.
Apakah urutan reaksi global? Unit apa yang akan k?
Susunan tindak balas mengenai atau2 Ia adalah 1, dan urutan reaksi berkenaan dengan tidak2 Ia adalah 2, jadi urutan reaksi global adalah jumlah nilai -nilai ini, iaitu, 2 + 1 = 3.
Kelajuan tindak balas mempunyai unit M/S, dan kepekatan reagen dinyatakan dalam m. Membuat analisis unit yang akan kita miliki:
k = kelajuan tindak balas / ([tidak2]2· [Sama ada2]
= (M / s) / (m3)
= s-1M-2
Latihan yang diselesaikan
Latihan 1
Data tindak balas berikut diperoleh pada 25 ° C:
A +2 B → C +2 D
Apakah ungkapan undang -undang kelajuan tindak balas ini? Berapakah nilai kelajuan anda tetap?
Pengiraan pesanan tindak balas
Data eksperimen adalah:
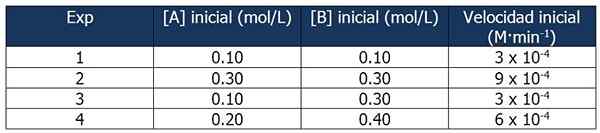 Data Cinetik Latihan 1. Sumber: Gabriel Bolívar.
Data Cinetik Latihan 1. Sumber: Gabriel Bolívar. Perbandingan Eksperimen 1 dan 3 membolehkan anda membuat kesimpulan berikut:
Perkadaran antara kelajuan reaksi 3 dan 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Tetapi perkadaran antara kepekatan B adalah:
(0.3 mol / l) / (0.1 mol/l) = 3
Kelajuan tindak balas adalah bebas daripada kepekatan b, kerana kenaikannya tidak menjejaskannya. Oleh itu, urutan tindak balas berkenaan dengan reagen b adalah sifar.
Sebaliknya, perbandingan reaksi 4 dan 1 membolehkan kesimpulan berikut:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Sementara itu, perkadaran antara [A] reaksi 4 dan 1 adalah sama dengan:
Boleh melayani anda: 5 ciri campuran homogen(0.20 mol / l) / (0.10 mol/l) = 2x
Maka hubungan antara perkadaran akan:
2 = 2x
x = 1
Oleh itu, ungkapan undang -undang kelajuan adalah:
Kelajuan tindak balas = k · [a]
B tidak diambil kerana urutan tindak balasnya adalah sifar.
Pengiraan k
Kita boleh mengira kelajuan pemalar dari mana -mana data kinetik. Mari gunakan Eksperimen 1:
K = kelajuan tindak balas / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 atau 0.003 min-1
Latihan 2
Data kelajuan tindak balas diperoleh pada suhu tertentu.
2 clo2 (ac) +2 oh- (AC) → CLO3- (ac) +clo2 (Ac) +h2Atau (l)
Pengiraan pesanan tindak balas
Data eksperimen adalah:
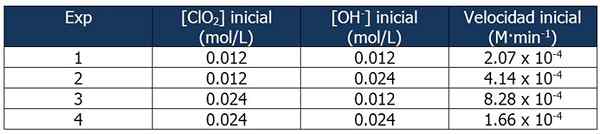 Data Cinetic mengenai Latihan 2. Sumber: Gabriel Bolívar.
Data Cinetic mengenai Latihan 2. Sumber: Gabriel Bolívar. Perkadaran antara kelajuan tindak balas 2 dan tindak balas 1 adalah:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
Dan perkadaran kepekatan OH- Antara tindak balas 2 dan 1 adalah sama dengan:
(0.024 mol/l)/(0.012 mol/l) = 2x
Eksponen 'x' mewakili susunan tindak balas berkenaan dengan reagen OH-. Hubungan antara perkadaran yang dikira boleh diwakili seperti berikut:
2 = 2x
x = 1
Oleh itu, urutan tindak balas berkenaan dengan reagen OH- sama dengan 1.
Dalam tindak balas 3 kepekatan CLO dua kali ganda2 tindak balas 1, sementara kepekatan oh- Tetap malar.
Perkadaran antara kelajuan reaksi 3 dan 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
Dan perkadaran [CLO2] Antara tindak balas 3 dan 1 adalah sama dengan:
(0.024 mol/l)/(0.012 mol/l) = 2dan
Eksponen 'dan' mewakili susunan tindak balas mengenai reagen CLO2.
Membandingkan perkadaran:
22 = 2dan
4 = 2dan
y = 2
Oleh itu, tindak balas kedua berkenaan dengan reagen CLO2.
Ekspresi undang -undang kelajuan akan menjadi:
Kelajuan tindak balas = k · [CLO2]2· [OH-]
Pengiraan k
Sekali lagi, kita dapat mengira k dari ungkapan sebelumnya menggunakan mana -mana data kinetik untuk eksperimen. Kami akan menggunakan Eksperimen 3:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Wikipedia. (2020). Pemalar kadar tindak balas. Diperoleh dari: dalam.Wikipedia.org
- Kimia Texas A & M University. (s.F.). Kinetik: Pengiraan kadar sampel. Pulih dari: chem.Tamu.Edu
- Keith J. Laidler. (2020). Kadar tindak balas. Britannica Encyclopaedia. Pulih dari: Britannica.com
- Helmestine, Anne Marie, Ph.D. (25 Ogos, 2020). Berapakah kadar pemalar dalam kimia? Pulih dari: Thoughtco.com
- Clark Jim. (2013). Kadar pemalar dan persamaan Arrhenius. Pulih dari: chemguide.co.UK

