Asas Coulombimetry, Jenis, Aplikasi

- 1529
- 350
- Ms. Micheal Rippin
The Coulombimetry Ia adalah teknik analisis elektrokimia yang terdiri daripada menjalankan elektrolisis yang lengkap, supaya analit dapat dikira; iaitu, untuk menentukan kepekatan analit dalam masalah masalah melalui pengoksidaan atau pengurangan lengkapnya. Ia adalah, tidak seperti potentiometri, teknik dinamik, kerana arus dibenarkan mengalir dengan bebas melalui sel elektrokimia.
Seperti namanya, caj elektrik Q, dalam unit Coulomb, C, diukur dan dikaitkan dengan kepekatan analit yang teroksida atau dikurangkan dalam periferi elektrod. Oleh itu, keadaan pengoksidaan perubahan analit, yang berlaku dalam proses pemindahan dan penyerapan elektron yang membolehkan pengiraan stoikiometrik kepekatan yang dikehendaki.
 Perhimpunan asas untuk elektrolisis di mana beberapa spesies berwarna -warni dibentuk kerana pH dan kompleks penghuni yang hadir. Sumber: Steve Jurvetson dari Menlo Park, USA, CC oleh 2.0, melalui Wikimedia Commons
Perhimpunan asas untuk elektrolisis di mana beberapa spesies berwarna -warni dibentuk kerana pH dan kompleks penghuni yang hadir. Sumber: Steve Jurvetson dari Menlo Park, USA, CC oleh 2.0, melalui Wikimedia Commons Dalam coulombimetry bateri atau potentiostat digunakan untuk mengawal arus atau potensi yang digunakan untuk sel. Sel -sel ini, tidak seperti potentiometric, terdiri daripada sistem tiga elektrod, dan dilengkapi dengan voltmeter dan ammeter.
Coulombimetry membentangkan kelebihan dapat melaksanakan ijazah tanpa menyediakan atau menyeragamkan corak. Ia juga membolehkan mengukur jumlah analit yang sangat kecil dan terhad, seperti kation logam, sebatian bukan organik dan sebatian organik. Sebagai contoh, terdapat coulometer yang direka khas untuk mengukur Co2 dibubarkan dalam sampel dari lautan.
Teknik ini menawarkan laluan analisis yang berbeza daripada volumetrik dan potentiometrik, begitu banyak analisis, bergantung kepada sifat elektrokimia analit, boleh membangunkan coulombimetrically.
Asas teoretis coulombimetry
Undang -undang Faraday
Coulombimetry berdasarkan undang -undang Faraday, yang mewujudkan hubungan antara caj elektrik sel elektrokimia dan jumlah analit yang mengoksida atau mengurangkan. Mengetahui beban ini q, serta beban elektron (1.6 · 10-19 C), anda boleh mengira bilangan elektron yang terlibat dalam tindak balas, ndan-:
ndan- = Q/E
Sebaliknya, diketahui bahawa satu mol elektron (6.02 · 1023) Porta Caj elektrik sama dengan 96485 C, angka yang dikenali sebagai pemalar Faraday:
F = dalamKe
= 96485.3365 c/mol
Mudah untuk menyatakan jumlah elektron bergantung pada tahi lalat. Terima kasih kepada ini, pekali stoikiometrik tindak balas elektrokimia boleh digunakan, menjadi pengoksidaan atau pengurangan, dengan mengambil kira berapa banyak tahi lalat elektron menang atau kehilangan spesies.
Boleh melayani anda: natrium fosfat: struktur, sifat, sintesis, kegunaanPengiraan asas
Sebagai contoh, pertimbangkan persamaan kimia berikut:
OX + 2E- → Rangkaian
Mengukur bahawa apabila keseluruhan spesies lembu telah dikurangkan ke rangkaian, kita dapat mengira tahi lalat OX menggunakan faktor penukaran:
xq · (mol e- /96485.3365 c) · (mol ox/ 2mol e-) = mol lembu
Iaitu, seperti yang kita tahu caj elektrik untuk mol elektron, kita akan mempunyai berapa banyak elektron yang sesuai dengan beban xq. Tetapi pada gilirannya, setiap 2 tahi lalat elektron ini digunakan untuk mengoksidakan 1 mol lembu.
Penalaran ini menyebabkan formula langsung, walaupun tidak disyorkan untuk menghafalnya, tetapi dapat menyimpulkannya seperti yang dilakukan:
n = Q/(fñdan-)
Di mana ñdan- Ia adalah bilangan tahi lalat elektron dalam persamaan kimia.
Dengan syarat bahawa ia boleh dikira Q, tanpa mengira jenis coulombimetry, tahi lalat OX atau analit rangkaian dapat ditentukan; Selagi, kecekapan arus adalah 100%. Yang terakhir bermaksud bahawa semua beban yang mesti menjadi produk hanya satu transformasi, tanpa spesies lain dikurangkan atau dioksidakan.
Asas eksperimen coulombimetry
Sel
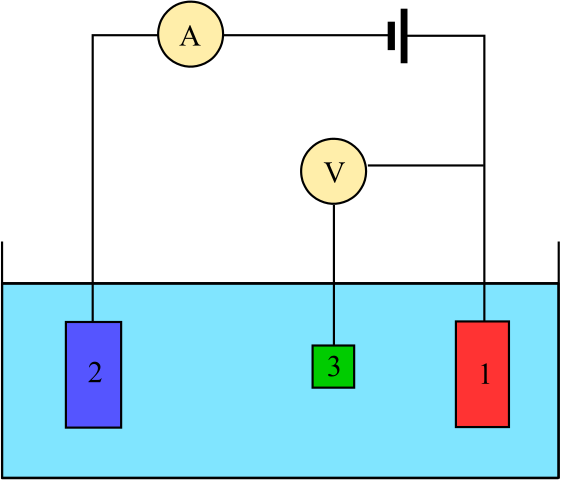 Rajah untuk sel elektrokimia yang terdiri daripada tiga elektrod: rujukan (3), pembantu (2) dan kerja (1). Sumber: Adam Rędzikowski, CC BY-SA 3.0, melalui Wikimedia Commons
Rajah untuk sel elektrokimia yang terdiri daripada tiga elektrod: rujukan (3), pembantu (2) dan kerja (1). Sumber: Adam Rędzikowski, CC BY-SA 3.0, melalui Wikimedia Commons Up kita mempunyai rajah untuk sel dengan tiga elektrod, yang biasanya digunakan dalam analisis coulombimetric. Reaksi redoks berlaku di kalangan elektrod kerja (1) dan tambahan (2). Antaranya dua disambungkan bateri, untuk menggunakan potensi ke sel, dan ammeter (a), untuk mengukur arus elektrik.
Walau bagaimanapun, elektrod rujukan (3) diperlukan untuk dapat memantau potensi elektrod kerja, dan dengan itu mengetahui variasi potensi untuk elektrod tambahan. Dengan cara ini, potensi seluruh sel dapat ditentukan, dansel, perlu untuk menganggarkan akhir tindak balas redoks dalam salah satu jenis coulombimetry.
Perhatikan bahawa antara elektrod kerja dan elektrod rujukan hampir tidak mengalir arus kerana voltmeter impedans yang tinggi (v), terima kasih kerana terdapat bacaan potensi untuk elektrod kerja. Di antara kedua -dua elektrod ini kita mempunyai sistem yang serupa dengan analisis potentiometrik: ia adalah statik dan tidak dinamik.
Ia boleh melayani anda: Kimia Nuklear: Sejarah, Bidang Pengajian, Kawasan, AplikasiPotensi
Coulombimetry adalah, jadi untuk bercakap, elektrolisis yang dijalankan untuk tujuan analisis dan kuantitatif. Oleh itu, terdapat perbincangan mengenai penggunaan potensi luaran, yang dibekalkan oleh bateri, untuk menjalankan tindak balas elektrokimia bukan -spontan; iaitu, yang mempunyai potensi negatif.
Pertimbangkan, sebagai contoh, tindak balas berikut disertai dengan piawaian berpotensi masing -masing:
Cu2+ + 2e- ⇌ cu (s) eºgrid = +0.337 v
H2Atau ⇌ 1/2o2(g) + 2h+ + 2e- Eºgrid = +1.230 v
Menjadi persamaan reaksi global yang sama dengan:
Cu2+ + H2Atau ⇌ cu (s) + 1/2o2(g) + 2h+ Eºgrid = -0.893 v
Bateri mesti menggunakan potensi 0.893 V supaya elektrod tembaga dan pembentukan ion hidrogen mungkin. Potensi ini adalah esel. Walau bagaimanapun, dalam praktiknya, potensi yang lebih besar daripada yang dikira mesti digunakan, kerana terdapat potensi yang menentang evolusi reaksi:
Dansel = EKatod - Dananod - Op - ir - cp
Di mana,
OP: Overpotential (halangan kinetik)
IR: OHMIC (potensi intrinsik ke sel)
CP: Polarisasi kepekatan (produk penurunan dalam CU2+)
Jenis coulombimetry
Terdapat tiga jenis coulombimetry: amperostatik, potentiostatic, dan elektrogravimetrik.
Amperostatik atau galvanostatik
Dalam jenis coulombimetry ini, arus yang berjalan melalui sel adalah malar dengan menggunakan amperostat. Oleh itu, mempunyai semasa Yo Terima kasih kepada pembacaan ammeter, dan juga mengetahui masa t Sebaik sahaja elektrolisis berakhir, kita boleh mengira beban yang berkaitan dengan transformasi analit:
Q = Item
Akibat menjaga pemalar semasa ialah perubahan potensi elektrod, sama ada secara positif atau negatif. Variasi tiba -tiba ini menunjukkan bahawa analit telah bertindak balas sepenuhnya, iaitu apabila elektrolisis berhenti dan diukur t. Ini adalah asas untuk darjah coulometric.
Sekiranya potensi berterusan atau dimuat naik, spesies elektroaktif yang tidak diingini akan bertindak balas. Itulah sebabnya potensi yang berkaitan dengan transformasi kepentingan harus diketahui dengan sempurna.
Potentiostatic
Satu cara untuk mencegah spesies lain. Di sinilah coulombimetry potentiosotik memasuki, kerana ia menggunakan potentiostete untuk menetapkan potensi tertentu untuk sel. Tidak seperti coulombimetry amperostatic, kini kini adalah semasa yang berubah seiring dengan masa berlangsung.
Boleh melayani anda: toluena: struktur, sifat, kegunaan, memperolehOleh kerana konfigurasi teknikal ini, kita tidak dapat mengira secara langsung dengan nilai -nilai Yo dan t; Semasa berkurangan dari masa ke masa. Ini kerana sebagai reaksi analit, akan ada molekul atau atom yang kurang dan kurang yang menderma atau menerima elektron. Oleh itu, yang sama dengan kawasan yang bersepadu di bawah lengkung grafik Yo Vs t.
Electrographic
Coulombimetry elektrografi, hanya dikenali sebagai elektrogravimetri, adalah elektrolisis di mana ia tidak perlu untuk mengukur beban atau arus elektrik. Sebaliknya, jisim elektrod diukur sebelum dan selepas elektrolisis.
Teknik ini hanya terpakai apabila spesies yang dikurangkan adalah kation logam yang elektrodepos pada elektrod, menjadikannya lebih berat.
Aplikasi
Potentiostetik
Analisis potentiostetik membolehkan mengurangkan atau mengoksida secara selektif satu spesies pada satu masa di tengah -tengah campuran. Sebagai contoh, ia digunakan untuk menentukan kepekatan ion bukan organik berikut dalam kuantiti jejak, atau dalam matriks kompleks:
-Cu2+
-Ace3+
-CD2+
-Co2+
-Iman2+ dan iman3+
-Pb2+
-X (f-, Cl-, Br- dan saya-)
-Tidak2+
-Pu3+
-Ag+
-Sn2+
-Zn2+
-Atau6+
Juga, analisis ini boleh digunakan untuk menentukan komposisi aloi. Setelah aloi asid dibubarkan, potensi sel digunakan dengan cara yang berperingkat dan terkawal, dengan itu menentukan jumlah yang dikurangkan bagi setiap kation logam yang mengintegrasikannya.
Ijazah Coulometric
Dalam darjah coulometric, ejen pengantara digunakan yang pastikan untuk meneutralkan sepenuhnya atau bertindak balas dengan baki analit. Tujuannya adalah untuk mencegah variasi yang berpotensi, kepada arus berterusan, memperoleh reaksi cagaran. Oleh itu, kemungkinan pemegang, contohnya, asid askorbik menggunakan iodin sebagai pengantara.
Beberapa kation logam, seperti AG+, Ec3+, Iman3+, Mn2+, Anda3+, Cr2+, Mereka juga boleh ditentukan oleh darjah ini.
Sebaliknya, tindak balas asid-asas masih boleh menggunakan teknik ini, kerana potensi besar menyebabkan air menjadi ionik3Sama ada+ atau oh-, yang berkhidmat dari ejen tajuk yang dihasilkan di situ; iaitu, mereka akan meneutralkan asid atau pangkalan yang hadir.
Co2 lautan, tindak balas pemendakan, dan pembentukan kompleks dengan EDTA, juga mungkin untuk menganalisisnya dengan menggunakan darjah coulometric, di mana penunjuk redoks ditambah untuk menyerlahkan titik akhir elektrolisis.
Rujukan
- Hari, r., & Underwood, a. (1986). Kimia Analisis Kuantitatif (Kelima ed.). Pearson Prentice Hall.
- Skoog d.Ke., Barat d.M. (1986). Analisis instrumental. (Kedua ed.). Inter -American., Mexico.
- Dr. Doug Stewart. (2020). Definisi coulometry. Pulih dari: chemicool.com
- Wikipedia. (2020). Coulometry. Diperoleh dari: dalam.Wikipedia.org
- Harvey David. (5 Jun, 2019). Kaedah Coulometric. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- « Rangka Kerja Metodologi Cara Menulisnya, Struktur, Contoh
- Asal Falsafah Kontemporari, Ciri, Arus, Penulis »

