Chrome (CR)

- 4870
- 634
- Dallas Bernhard
 Chrome adalah logam yang sangat reaktif. Wikimedia Commons
Chrome adalah logam yang sangat reaktif. Wikimedia Commons Apa itu Chrome?
Dia Chrome (Cr) adalah elemen kimia kumpulan 6 (VIB) dari jadual berkala. Setiap tahun tan logam ini dihasilkan oleh pengekstrakan mineral kromit atau magnesium (FECR2Sama ada4, Mgcr2Sama ada4), yang dikurangkan dengan arang batu untuk mendapatkan logam. Ia sangat reaktif, dan hanya dalam keadaan yang sangat mengurangkan keadaannya dalam bentuk murni.
Mineral dan oksida, serta bahagian tembaga logam kecil, menjadikan elemen ini menduduki nombor 22 yang paling banyak korteks bumi.
Kimia kromium sangat pelbagai kerana ia boleh membentuk pautan dengan hampir keseluruhan jadual berkala. Setiap sebatiannya mempamerkan warna yang bergantung kepada nombor pengoksidaan, serta spesies yang berinteraksi dengannya.
Juga, bentuk pautan ke karbon, campur tangan dalam sebilangan besar sebatian organometali.
Ciri dan sifat krom
Chromium adalah logam perak dalam bentuk tulennya, dengan nombor atom 24 dan berat molekul kira -kira 52 g/mol (52CR, isotop yang paling stabil).
Memandangkan pautan logam yang kuat, ia membentangkan titik gabungan (1907 ºC) dan mendidih (2671 ºC) tinggi. Juga, struktur kristalnya menjadikannya logam yang sangat padat (7.19 g/ml).
Ia tidak bertindak balas dengan air untuk membentuk hidroksida, tetapi dengan asid. Ia mengoksidakan dengan oksigen udara yang umumnya menghasilkan oksida kromik, yang merupakan pigmen hijau yang digunakan secara meluas.
Lapisan oksida ini mencipta apa yang dikenali sebagai Passivation, Melindungi logam dari kakisan berikutnya, kerana oksigen tidak dapat menembusi sinus logam.
Konfigurasi elektroniknya ialah [AR] 4S13d5, Dengan semua elektron yang hilang, dan oleh itu, ia mempamerkan sifat paramagnetik. Walau bagaimanapun, mengawan putaran elektronik boleh berlaku jika logam tertakluk kepada suhu rendah, memperoleh sifat lain, seperti antiferromagnetisme.
Boleh melayani anda: bahan refraktoriStruktur krom kimia
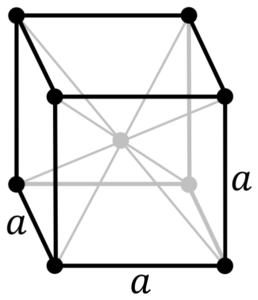 Struktur logam krom. Sumber: Oleh PNG Asal oleh Daniel Mayer, Drbob, Wikimedia Commons
Struktur logam krom. Sumber: Oleh PNG Asal oleh Daniel Mayer, Drbob, Wikimedia Commons Apakah struktur logam krom? Dalam bentuk murni, Chromium mengamalkan struktur kristal padu yang berpusat pada badan (CC atau BCC). Ini bermaksud bahawa atom krom terletak di tengah kiub, yang tepinya diduduki oleh krom lain (seperti dalam imej yang unggul).
Struktur ini bertanggungjawab untuk Chrome yang mempunyai titik lebur dan mendidih yang tinggi, serta kekerasan yang besar. Atom tembaga bertindih orbital S dan D mereka untuk membentuk band memandu mengikut teori band.
Oleh itu, kedua -dua band penuh separuh kerana konfigurasi elektronik mereka adalah [AR] 4S13d5, Dan sebagai orbital s, boleh menempatkan dua elektron, dan orbital sepuluh. Kemudian, hanya separuh daripada kumpulan yang dibentuk oleh tumpang tindih mereka diduduki oleh elektron.
Dengan kedua -dua perspektif ini -struktur kristal dan pautan logam -banyak sifat fizikal logam ini dapat dijelaskan secara teori. Walau bagaimanapun, tidak menjelaskan mengapa Chrome boleh mempunyai beberapa negeri atau nombor pengoksidaan.
Untuk ini, pemahaman yang mendalam tentang kestabilan atom berkenaan dengan putaran elektronik.
Nombor pengoksidaan krom
Kerana konfigurasi elektronik krom adalah [AR] 4S13d5 Anda boleh menang sehingga satu atau dua elektron (CR1- dan Cr2-), atau kehilangan mereka untuk memperoleh nombor pengoksidaan yang berbeza.
Oleh itu, jika krom kehilangan elektron, ia akan menjadi [ar] 4s03d5; Sekiranya anda kehilangan tiga, [AR] 4S03d3; Dan jika anda kehilangan mereka semua, [ar], atau apa yang sama, ia akan menjadi isolektronik untuk argon.
Boleh melayani anda: titik mendidih: konsep, pengiraan dan contohKromium tidak kehilangan atau memperoleh elektron kerana kehendak semata -mata: mesti ada spesies yang dilakukan atau menerimanya dari satu nombor pengoksidaan ke yang lain.
Kromium mempunyai nombor pengoksidaan berikut: -2, -1, 0, +1, +2, +3, +4, +5 dan +6. Daripada mereka +3, cr3+, Ia adalah yang paling stabil dan oleh itu utama semua; diikuti dengan +6, Cr6+.
Kegunaan Chrome
Sebagai pewarna atau pigmen
Kromium mempunyai pelbagai aplikasi, dari pewarna untuk pelbagai jenis kain, kepada pelindung yang menghiasi bahagian logam, dalam apa yang dikenali sebagai krom, yang boleh dilakukan dengan logam tulen, atau dengan sebatian Cr (iii) atau Cr (Vi).
Fluoruro Cromik (CRF3), sebagai contoh, ia digunakan sebagai pewarna untuk kain bulu; Sulfat cromik (CR2(SW4)3), ia ditakdirkan untuk berwarna enamel, seramik, lukisan, dakwat, varnis, dan juga berfungsi untuk logam kromar; dan oksida krom (CR2Sama ada3) Juga mencari penggunaan di mana warna hijau yang menarik diperlukan.
Oleh itu, mana -mana mineral krom dengan warna yang sengit boleh ditakdirkan untuk mewarnai struktur, tetapi selepas itu fakta sama ada sebatian ini berbahaya atau tidak untuk alam sekitar atau untuk kesihatan individu.
Malah, sifat beracunnya digunakan untuk memulihara kayu dan permukaan serangan serangga lain.
Dalam krom atau metalurgi
Begitu juga, sejumlah kecil krom ke keluli ditambah untuk mengukuhkannya dalam menghadapi pengoksidaan dan meningkatkan kecerahannya. Ini kerana ia mampu membentuk karbida kelabu (CR3C2) Sangat tahan apabila bertindak balas dengan oksigen udara.
Boleh melayani anda: kalsium hidroksida (Ca (OH) 2): struktur, sifat, mendapatkan, menggunakanKerana krom boleh menggilap sehingga permukaan terang, krom kemudian menyajikan reka bentuk dan warna perak sebagai alternatif yang lebih murah untuk tujuan ini.
Pemakanan
Beberapa perdebatan jika kromium boleh dianggap sebagai elemen penting, iaitu, sangat diperlukan dalam diet harian. Ia terdapat dalam beberapa makanan dalam kepekatan yang sangat kecil, seperti daun hijau dan tomato.
Terdapat juga suplemen protein yang mengawal aktiviti insulin dan memihak kepada pertumbuhan otot, seperti halnya dengan polynicotinato krom.
Di mana krom?
Kromium ditemui dalam pelbagai jenis mineral dan permata, seperti batu permata dan zamrud. Mineral utama dari mana krom diekstrak adalah kromit (mCR2Sama ada4), Di mana m boleh menjadi logam lain yang dikaitkan dengan kromium oksida. Lombong -lombong ini berlimpah di Afrika Selatan, di India, Turki, Finland, Brazil dan negara -negara lain.
Setiap sumber mempunyai satu atau lebih varian kromit. Dengan cara ini, untuk setiap m (iman, mg, mn, zn, dll.) Mineral krom yang berbeza timbul.
Untuk mengekstrak logam itu perlu. Ini dilakukan dengan karbon atau aluminium:
Fecr2Sama ada4 + 4C => Fe + 2CR + 4CO
Begitu juga, Chromita dijumpai (pbcro4).
Biasanya, di mana -mana mineral di mana ion cr3+ boleh menggantikan al3+, Kedua -duanya dengan radio ionik yang sedikit serupa, merupakan kekotoran yang mengakibatkan sumber semula jadi logam yang menakjubkan tetapi berbahaya ini.
Rujukan
- Tenebaum e. Chromium. Diambil dari: Kimia.Pomona.Edu
- Kimia Librettexts. Kimia Kromium. Diambil dari: chem.Libretxts.org
- Chromium. Diambil dari: KimiaExplaed.com

