Berapakah undang -undang kimia? (Contoh)

- 1626
- 301
- Clarence Greenholt DDS
The Undang -undang Kimia Weareral Mereka adalah mereka yang telah menunjukkan bahawa massa bahan -bahan yang bertindak balas tidak berbuat demikian secara sewenang -wenang atau rawak; tetapi mengekalkan perkadaran matematik yang berterusan bagi seluruh bilangan atau submulit mereka, di mana atom -atom unsur -unsur tidak dicipta atau dimusnahkan.
Pada masa -masa yang lalu, undang -undang ini memerlukan usaha yang luar biasa untuk penalaran; Kerana walaupun sekarang nampaknya terlalu jelas, sebelum massa atom atau molekul unsur -unsur atau sebatian tidak diketahui, masing -masing.
 Sumber: Jeff Keyzer dari Austin, TX, USA [CC BY-SA 2.0 (https: // creativeCommons.Org/lesen/by-sa/2.0)]
Sumber: Jeff Keyzer dari Austin, TX, USA [CC BY-SA 2.0 (https: // creativeCommons.Org/lesen/by-sa/2.0)] Oleh kerana ia tidak diketahui betapa tepatnya mol atom setiap elemen bersamaan, bahan kimia abad kelapan belas dan kesembilan belas harus berdasarkan pada massa yang bertindak balas. Jadi skala analisis asas (imej unggul) adalah sahabat yang tidak dapat dipisahkan semasa beratus -ratus eksperimen yang diperlukan untuk penyelesaian undang -undang berat.
Oleh sebab itu, apabila undang -undang kimia ini dikaji, mereka tersandung pada pengukuran massa pada setiap saat. Terima kasih kepada ini, mengekstrapolasi hasil eksperimen, didapati bahawa sebatian kimia Murni Mereka selalu membentuk dengan jumlah besar unsur konstituen mereka.
[TOC]
Undang -undang pemuliharaan jisim
Undang -undang ini mengatakan bahawa dalam tindak balas kimia, jumlah jisim reagen adalah sama dengan jumlah jisim produk; selagi sistem yang dipertimbangkan ditutup dan tidak ada pertukaran jisim dan tenaga dengan persekitarannya.
Dalam tindak balas kimia, bahan tidak hilang, tetapi diubah menjadi bahan -bahan lain yang sama dengan jisim yang sama; Dari sana frasa yang terkenal: "Tidak ada yang dicipta, tidak ada yang musnah, semuanya berubah".
Dari segi sejarah, undang -undang pemuliharaan massa dalam tindak balas kimia pertama kali dicadangkan pada tahun 1756 oleh Mikhail Lomonsov, yang menunjukkan di dalam buku hariannya hasil eksperimennya.
Seterusnya pada tahun 1774, Antoine Levoisier, seorang ahli kimia Perancis, membentangkan hasil eksperimennya yang dibenarkan untuk menubuhkannya; yang, ada juga yang menyebutnya undang -undang Lavoisier.
-Eksperimen Lavoisier
Pada masa Lavoisier (1743-1794), terdapat teori Flogisto, yang mana mayatnya mempunyai kemampuan untuk membakar atau membakar. Eksperimen lavoisier dibenarkan untuk membuang teori ini.
Lavoisier melakukan banyak eksperimen pembakaran logam. Dia berhati -hati menimbang bahan sebelum dan selepas pembakarannya dalam bekas tertutup, mendapati bahawa terdapat kenaikan berat badan yang jelas.
Tetapi lavoiser, berdasarkan pengetahuan tentang peranan oksigen dalam pembakaran, menyimpulkan bahawa kenaikan berat badan dalam pembakaran adalah disebabkan oleh penggabungan oksigen ke dalam bahan pembakaran. Konsep oksida logam dilahirkan.
Oleh itu, jumlah massa logam yang tertakluk kepada pembakaran dan oksigen tetap tidak dapat diubah. Kesimpulan ini membenarkan penubuhan undang -undang pemuliharaan massa.
-Mengimbangi persamaan
Undang -undang Pemuliharaan Massa menubuhkan keperluan untuk mengimbangi persamaan kimia, menjamin bahawa bilangan semua elemen yang terlibat dalam tindak balas kimia, serta reagen atau produk, adalah sama persis.
Ini adalah keperluan penting untuk ketepatan pengiraan stoikiometrik yang dibuat.
-Pengiraan
Moles air
Berapa banyak tahi lalat air yang boleh berlaku semasa pembakaran 5 tahi lalat metana dalam oksigen yang berlebihan? Juga menunjukkan bahawa undang -undang pemuliharaan bahan dipenuhi.
Ch4 + 2 o2 => Co2 + 2 jam2Sama ada
Mengamati persamaan reaksi yang seimbang, disimpulkan bahawa 1 mol metana menghasilkan 2 tahi lalat air.
Masalahnya dapat diselesaikan secara langsung dengan pendekatan yang mudah, kerana kita tidak mempunyai 1 mol tetapi 5 mol cho4:
Moles of Water = 5 Moles of Cho4· (2 mol h2O / 1 mol cho4)
= 10
Apa yang akan bersamaan dengan 180 g H2Sama ada. 5 mol atau 220 g CO juga terbentuk2, yang sama dengan jumlah jisim 400 g produk.
Oleh itu, bagi undang -undang pemuliharaan subjek untuk bertindak balas 400 g reagen; tidak lebih, tidak kurang. Daripada 400 g, 80 g sesuai dengan 5 mole cho4 (Mengalikan dengan jisim molekulnya 16 g/mol), dan 320 g pada 10 tahi lalat O2 (Begitu juga kerana jisim molekulnya 32 g/mol).
Pembakaran pita magnesium
Pita magnesium 1.50 g dibakar dalam bekas tertutup yang mengandungi 0.80 g oksigen. Selepas pembakaran, 0.25 g oksigen berada di dalam bekas. a) Apakah jisim oksigen bertindak balas? b) Berapa banyak magnesium oksida?
Boleh melayani anda: Penyelesaian hipotonik: komponen, penyediaan, contohJisim oksigen yang bertindak balas diperolehi dengan perbezaan yang mudah.
Massa oksigen yang dimakan = (jisim awal - jisim sisa) oksigen
= 0.80 g - 0.25 g
= 0.55 g atau2 (ke)
Menurut undang -undang pemuliharaan massa,
Jisim magnesium oksida = jisim magnesium +massa oksigen
= 1.50 g + 0.55 g
= 2.05 g Mgo (b)
Undang -undang perkadaran pasti
Joseph Louis Proust (1754-1826), ahli kimia Perancis, menyedari bahawa dalam tindak balas kimia unsur-unsur kimia selalu bertindak balas dalam perkadaran massa tetap untuk membentuk sebatian Murni khusus; Oleh itu, komposisinya adalah malar, tanpa mengira sumber atau asal, atau bagaimana ia disintesis.
Proust pada tahun 1799 menyatakan undang -undang perkadaran yang ditetapkan, yang menyatakan bahawa: "Apabila dua atau lebih elemen digabungkan untuk membentuk sebatian, mereka melakukannya dalam hubungan massa tetap". Oleh itu, hubungan ini tetap dan tidak bergantung kepada strategi yang diikuti untuk penyediaan kompaun.
Undang -undang ini juga dikenali sebagai undang -undang komposisi yang berterusan, yang menyatakan bahawa: "setiap kompaun kimia dalam kesucian selalu mengandungi unsur -unsur yang sama, dalam sebahagian besar jisim".
-Ilustrasi Undang -undang
Besi (iman) bertindak balas dengan sulfur (s) untuk membentuk besi sulfida (FES), tiga situasi boleh ditunjukkan (1, 2 dan 3):
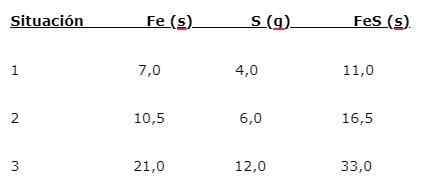
Untuk mencari perkadaran di mana unsur -unsur digabungkan, jisim utama (iman) dibahagikan dengan jisim kecil. Pengiraan memberikan kadar 1.75: 1. Nilai ini diulang dalam tiga syarat yang diberikan (1, 2 dan 3), di mana perkadaran yang sama diperoleh walaupun massa yang berbeza digunakan.
Iaitu 1.75 g iman digabungkan dengan 1.0 g s untuk memberi 2.75 g FES.
-Aplikasi
Melalui permohonan undang -undang ini, anda dapat mengetahui dengan tepat jisim unsur -unsur yang mesti digabungkan untuk mendapatkan jisim yang dikehendaki dari sebatian.
Dengan cara ini, maklumat mengenai jisim sisa mana -mana unsur yang terlibat dalam tindak balas kimia boleh diperolehi, atau jika terdapat reagen yang mengehadkan dalam reaksi.
Di samping itu, ia terpakai untuk mengetahui komposisi sentuhan sebatian, dan berdasarkan yang terakhir, formula sebatian dapat diwujudkan.
Komposisi Centesimal Sebuah Kompaun
Karbon dioksida (CO2) terbentuk dalam reaksi berikut:
C +o2 => Co2
12 g karbon 32 g oksigen digabungkan untuk memberikan 44 g karbon dioksida.
Oleh itu, peratusan karbon adalah sama dengan
Peratusan Karbon = (12 g / 44 g) · 100 %
= 27.3 %
Peratusan oksigen = (32 g / 44 g) · 100 %
Peratusan oksigen = 72.7 %
Menggunakan pernyataan undang -undang komposisi malar, dapat diperhatikan bahawa karbon dioksida sentiasa dibentuk oleh 27.3 % karbon dan 72.7 % oksigen.
-Pengiraan
Sulfur trioksida
Dengan bertindak balas dalam bekas yang berbeza 4 g dan 6 g sulfur (s) dengan oksigen (O), masing -masing diperolehi, 10 g dan 15 g sulfur trioksida (begitu3).
Mengapa jumlah sulfur trioksida dan bukan yang lain?
Juga hitung jumlah sulfur yang diperlukan untuk menggabungkan dengan 36 g oksigen dan adunan sulfur trioksida yang diperolehi.
Bahagian A)
Dalam bekas pertama, 4 g g oksigen bercampur untuk mendapatkan 10 g trioksida. Sekiranya undang -undang pemuliharaan massa digunakan, kita dapat membersihkan jisim oksigen yang digabungkan dengan belerang.
Jisim oksigen = 10 g oksigen trioksida - 4 g sulfur.
= 6 g
Dalam bekas 2 6 g sulfur dicampur dengan x g oksigen untuk mendapatkan 15 sulfur trioksida.
Jisim oksigen = 15 g sulfur trioksida - 6 g sulfur
= 9 g
Perkadaran o/s untuk setiap bekas kemudian dikira:
Perkadaran o / s dalam keadaan 1 = 6 g o / 4 g s
= 1.5 / 1
Perkadaran o / s dalam keadaan 2 = 9 g o / 6 g s
= 1.5 / 1
Yang, bersetuju dengan apa yang dibangkitkan dalam undang -undang perkadaran yang ditetapkan yang menunjukkan bahawa unsur -unsur selalu digabungkan dalam perkadaran yang sama untuk membentuk sebatian tertentu.
Oleh itu, nilai yang diperoleh adalah betul dan yang sesuai dengan permohonan undang -undang.
Bahagian B)
Dalam bahagian sebelumnya nilai A 1.5 / 1 dikira untuk perkadaran o / s.
Boleh melayani anda: keadaan pengagregatan bahang sulfur = 36 oksigen · (1 g sulfur / 1.5 g oksigen)
= 24 g
g sulfur trioksida = 36 g oksigen + 24 g sulfur
= 60 g
Klorin dan magnesium
Klorin dan magnesium digabungkan dalam kadar 2.95 g klorin untuk setiap g magnesium. a) Tentukan massa klorin dan magnesium yang diperlukan untuk mendapatkan 25 g magnesium klorida. b) Berapakah komposisi peratusan magnesium klorida?
Bahagian A)
Berdasarkan nilai 2.95 untuk nisbah CL: MG, pendekatan berikut boleh dibuat:
2.95 g cl +1 g mg => 3.95 g MgCl2
Kemudian:
g of Cl = 25 g mgcl2 · (2.95 g Cl / 3.95 g MgCl2)
= 18.67
G mg = 25 g mgcl2 · (1 g mg / 3.95 g MgCl2)
= 6.33
Kemudian, 18.67 g klorin digabungkan dengan 6.33 g magnesium untuk menghasilkan 25 g magnesium klorida.
Bahagian B)
Jisim molekul magnesium klorida, mgcl dikira terlebih dahulu2:
Berat molekul MGCL2 = 24.3 g/mol + (2 · 35.5 g/mol)
= 95.3 g/mol
Peratusan Magnesium = (24.3 g / 95.3 g) x 100 %
= 25.5 %
Peratusan Klorin = (71 g / 95.3 g) x 100 %
= 74.5 %
Undang -undang pelbagai perkadaran atau undang -undang Dalton
Undang -undang itu dinyatakan pada tahun 1803 oleh ahli kimia dan ahli meteorologi Perancis John Dalton, berdasarkan pemerhatiannya mengenai reaksi gas atmosfera.
Undang -undang itu dinyatakan seperti berikut: "Apabila unsur -unsur digabungkan untuk memberikan lebih dari satu kompaun, jisim yang berubah -ubah salah satu dari mereka bergabung dengan jisim tetap yang lain dan yang pertama mempunyai hubungan kanon dan nombor yang tidak jelas".
Juga: "Apabila dua elemen digabungkan untuk menyebabkan sebatian yang berbeza, diberi jumlah tetap salah satu daripada mereka, jumlah yang berbeza dari elemen lain yang digabungkan dengan jumlah tetap untuk menghasilkan sebatian, berhubung dengan nombor keseluruhan yang mudah".
John Dalton membuat penerangan moden pertama atom sebagai komponen unsur -unsur kimia, ketika dia menegaskan bahawa unsur -unsur dibentuk oleh zarah -zarah yang tidak dapat dipanggil atom.
Di samping.
Dalton menyelesaikan kerja penyelidikan Proust. Beliau menunjukkan kewujudan dua oksida timah, dengan peratusan sebanyak 88.1% dan 78.7% timah dengan peratusan oksigen, 11.9% dan 21.3% masing -masing.
-Pengiraan
Air dan hidrogen peroksida
Tunjukkan bahawa sebatian air, h2Atau, dan hidrogen peroksida, h2Sama ada2, Mereka mematuhi undang -undang pelbagai perkadaran.
Berat atom unsur: H = 1 g/mol dan oksigen = 16 g/mol.
Peso molekul sebatian: h2O = 18 g/mol dan h2Sama ada2 = 34 g/mol.
Hidrogen adalah elemen dengan jumlah tetap dalam h2Atau dan h2Sama ada2, Jadi perkadaran antara O dan H akan ditubuhkan di kedua -dua sebatian.
Nisbah o/h dalam h2O = (16 g/mol)/(2 g/mol)
= 8/1
Nisbah o/h dalam h2Sama ada2 = (32 g/mol)/(2 g/mol)
= 16/1
Hubungan antara kedua -dua perkadaran = (16/1)/(8/1)
= 2
Kemudian, nisbah atau/h antara hidrogen peroksida dan air adalah 2, bilangan integer dan mudah. Terdapat pematuhan yang ditunjukkan dengan undang -undang pelbagai perkadaran.
Nitrogen oksida
Jisim oksigen apa yang digabungkan dengan 3.0 g nitrogen dalam a) nitrik oksida, tidak dan b) nitrogen dioksida, tidak2. Menunjukkan bahawa tidak dan tidak2 Mereka mematuhi undang -undang pelbagai perkadaran.
Jisim nitrogen = 3 g
Berat atom: nitrogen, 14 g/mol, dan oksigen, 16 g/mol.
Pengiraan
Dalam NO, atom N digabungkan dengan 1 atom O, supaya jisim oksigen yang digabungkan dengan 3 g nitrogen boleh dikira dengan pendekatan berikut:
G of o = g nitrogen · (PA. O / pa. N)
= 3 g · (16 g/mol/14 g/mol)
= 3.43 g atau
Dalam no2, Atom N digabungkan dengan 2 atom O, jadi jisim oksigen yang digabungkan adalah:
g oksigen = 3 g · (32 g/mol/14 g/mol)
= 6.86 g atau
Perkadaran o/ n pada no = 3.43 g o/ 3 g n
= 1,143
Perkadaran atau/n dalam no2 = 6.86 g o / 3 g n
= 2,282
Nilai hubungan antara perkadaran o / n = 2,282 / 1,143
= 2
Kemudian, nilai hubungan antara perkadaran atau/n ialah 2, integer dan nombor mudah. Oleh itu, undang -undang pelbagai perkadaran dipenuhi.
Undang -undang perkadaran timbal balik
Undang -undang ini dirumuskan oleh Richter dan Carl F. Wenzel berasingan.
Boleh melayani anda: natrium: sejarah, struktur, sifat, risiko dan kegunaanSebagai contoh, jika anda mempunyai dua sebatian ab dan cb, diperhatikan bahawa elemen umum adalah b.
Undang-undang Richter-Wenzel atau perkadaran timbal balik mengatakan bahawa, mengetahui berapa banyak A bertindak balas dengan B untuk memberi ab, dan berapa banyak C bertindak balas dengan B untuk memberi CB, anda boleh mengira jisim yang diperlukan untuk bertindak balas dengan massa c Borang AC.
Dan hasilnya ialah perkadaran kepada: c atau a/c mestilah berbilang atau submultiple a/b atau c/b. Walau bagaimanapun, undang -undang ini tidak selalu dipenuhi, terutamanya apabila unsur -unsur hadir beberapa keadaan pengoksidaan.
Dari semua undang -undang berat ini mungkin yang paling "abstrak" atau rumit. Tetapi jika dianalisis dari sudut pandangan matematik, ia akan dilihat hanya terdiri daripada faktor penukaran dan pembatalan.
-Contoh
Metana
Jika diketahui bahawa 12 g karbon bertindak balas dengan 32 g oksigen untuk membentuk karbon dioksida; Dan itu, sebaliknya, 2 g hidrogen bertindak balas dengan 16 g oksigen untuk membentuk air, maka perkadaran massa c/o dan h/atau untuk CO boleh dianggarkan2 dan h2Atau, masing -masing.
Mengira c/o dan h/atau anda mempunyai:
C / o = 12g c / 32g atau
= 3/8
H / o = 2g h / 16g atau
= 1/8
Oksigen adalah elemen biasa, dan ia dikehendaki untuk mengetahui berapa banyak karbon bertindak balas dengan hidrogen untuk menghasilkan metana; Iaitu, anda ingin mengira c/h (atau h/c). Kemudian, adalah perlu untuk membuat pembahagian perkadaran sebelumnya untuk menunjukkan sama ada atau tidak timbal balik itu dipenuhi:
C/h = (c/o)/(h/o)
Perhatikan bahawa dengan cara ini OS dibatalkan dan c/h kekal:
C/h = (3/8)/(1/8)
= 3
Dan 3 adalah 3/8 berganda (3/8 x 8). Ini bermakna bahawa 3 g c bertindak balas dengan 1 g h untuk memberi metana. Tetapi, untuk dapat membandingkannya dengan CO2, Ia didarabkan c/h oleh 4, yang sama dengan 12; Ini memberikan 12 g c yang bertindak balas dengan 4 g h untuk membentuk metana, yang juga benar.
Magnesium sulfida
Jika diketahui bahawa 24 g magnesium bertindak balas dengan 2 g hidrogen untuk membentuk magnesium hidrida; Dan di samping itu, 32 g sulfur bertindak balas dengan 2 g hidrogen untuk membentuk hidrogen sulfida, elemen yang sama adalah hidrogen dan mahu mengira mg/s dari mg/h dan h/s.
Kemudian mengira mg/h dan h/s secara berasingan anda mempunyai:
Mg / h = 24g mg / 2g h
= 12
H / s = 2g h / 32g s
= 1/16
Walau bagaimanapun, mudah menggunakan S/H untuk membatalkan H. Oleh itu, s/h sama dengan 16. Melakukan ini, kami terus mengira Mg/S:
Mg/s = (mg/h)/(s/h)
= (12/16)
= 3/4
Dan 3/4 adalah submultiple 12 (3/4 x 16). Perkadaran mg/s menunjukkan bahawa 3 g mg bertindak balas dengan 4 g sulfur untuk membentuk magnesium sulfida. Walau bagaimanapun, anda perlu membiak mg/s dengan 8 untuk dapat membandingkannya dengan mg/h. Oleh itu, 24 g mg bertindak balas dengan 32 g sulfur untuk memberikan sulfida logam ini.
Aluminium chloride
Diketahui bahawa 35.5 g cl bertindak balas dengan 1 g h untuk membentuk HCl. Juga, 27 g Al bertindak balas dengan 3 g h untuk membentuk ALH3. Kirakan perkadaran aluminium klorida dan katakan jika sebatian itu mematuhi undang-undang Richter-Wenzel.
Sekali lagi, CL/H dan AT/H dikira secara berasingan:
Cl / h = 35.5g cl / 1g h
= 35.5
At/ h = 27g at/ 3g h
= 9
Sekarang, ia dikira ke/cl:
At/cl = (al/h)/(cl/h)
= 9/35.5
≈ 0.250 atau 1/4 (sebenarnya 0.253)
Iaitu, 0.250 g Al bertindak balas dengan 1 g dari Cl untuk membentuk garam yang sepadan. Tetapi, sekali lagi, ia mesti didarabkan ke/cl dengan nombor yang membolehkan membandingkannya (untuk keselesaan) dengan al/h.
Impresiasi dalam Pengiraan
Ia kemudiannya didarabkan di/Cl oleh 108 (0.27/250), memberikan 27 g yang mana ia bertindak balas dengan 108 g Cl. Ini tidak berlaku dengan tepat. Jika kita mengambil contoh nilai 0.253 oleh Al/Cl, dan kita membiaknya dengan 106.7 (27/0.253), 27 g Al bertindak balas dengan 106.7 g Cl; Yang, ia lebih mendekati realiti (ALCL3, dengan PA sebanyak 35.5 g/mol untuk CL).
Di sini diperhatikan bagaimana undang -undang Richter dapat mulai bertudung kerana ketepatan dan penyalahgunaan perpuluhan.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Bunga, j. Kimia (2002). Editorial Santillana.
- Joaquín San Frutos Fernández. (s.F.). Undang -undang berat dan volumetrik. Pulih dari: Encina.pntic.Mec.adalah
- Toppr. (s.F.). Undang -undang kombinasi kimia. Pulih dari: TOPPR.com
- Cemerlang. (2019). Undang -undang kombinasi kimia. Pulih dari: cemerlang.org
- Kimia Librettexts. (15 Julai 2015). Undang -undang kimia asas. Pulih dari: chem.Libretxts.org
- Helmestine, Anne Marie, Ph.D. (18 Januari 2019). Undang -undang pemuliharaan jisim. Pulih dari: Thoughtco.com

