Ciri -ciri Elektrod Rujukan, Fungsi, Contoh
- 3830
- 262
- Clarence Greenholt DDS
Dia elektrod rujukan Ia adalah peranti yang digunakan dalam analisis potentiometrik dan voltamétrik untuk penentuan kuantitatif analit. Kepentingannya adalah, seperti namanya, untuk menjadi rujukan untuk menganggarkan nilai sebenar potensi dalam reaksi separuh elektrokimia.
Potensi separa -media bergantung kepada kepekatan ion yang menarik, kerana ia bertindak balas dengan memenangi atau kehilangan elektron. Dengan cara ini, adalah mungkin untuk menentukan kepekatan mereka melalui potensi ini. Walau bagaimanapun, nilai mereka tidak mutlak tetapi berkaitan dengan elektrod hidrogen standard (dia dalam bahasa Inggeris).
 Rajah bahagian elektro hidrogen standard. Sumber: standard_hydrogen_electrode.JPG: Kaverinderivevative Work: Henry Muelpfordt/CC BY-S (http: // creativeCommons.Org/lesen/by-sa/3.0/)
Rajah bahagian elektro hidrogen standard. Sumber: standard_hydrogen_electrode.JPG: Kaverinderivevative Work: Henry Muelpfordt/CC BY-S (http: // creativeCommons.Org/lesen/by-sa/3.0/) Oleh konvensyen, potensi elektrod hidrogen sama dengan 0V. Masalahnya adalah bahawa elektrod ini sukar untuk dimanipulasi, jadi mereka tidak praktikal untuk memasangnya dalam semua analisis. Di sinilah elektrod rujukan masuk, lebih mudah, dan potensi yang berbeza dari 0V.
Sebilangan elektrod rujukan, seperti elektrod tepu Calomel (ESC), boleh dibina di makmal yang sama sebelum analisis dilakukan. Begitu juga, mereka diperoleh secara terbuka di pasaran dengan spesifikasi yang betul, dan risiko yang mencemarkan sampel analit adalah minimum.
[TOC]
Ciri -ciri elektrod rujukan
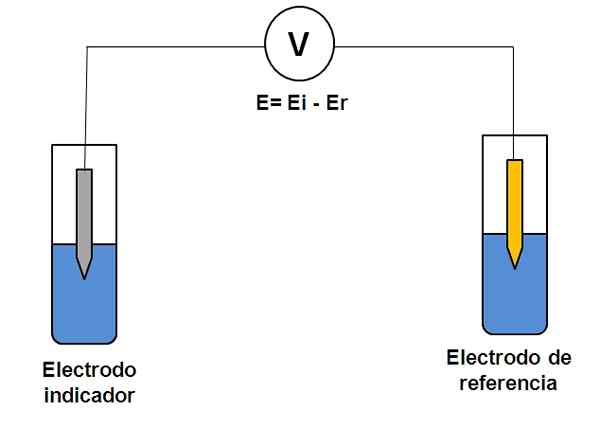 Perwakilan mudah dari dua sistem elektrod dalam potentiometri. Sumber: Gabriel Bolívar.
Perwakilan mudah dari dua sistem elektrod dalam potentiometri. Sumber: Gabriel Bolívar. Pertimbangkan kedua -dua sistem elektrod di atas. Satu adalah penunjuk (kelabu), di mana tindak balas minat berlaku, dan yang lain adalah rujukan (emas). Sel elektrokimia ini akan mempunyai potensi dan, yang akan sama dengan perbezaan potensi kedua-dua elektrod (Ei-E). Oleh itu, sebarang variasi dalam e mestilah disebabkan oleh potensi elektrod penunjuk.
Boleh melayani anda: kalium sianida (KCN): sifat, kegunaan, struktur, risiko,Dari yang di atas disimpulkan bahawa elektrod rujukan mempunyai ciri -ciri berikut:
-Ia mempunyai potensi yang stabil pada masa itu dan boleh dihasilkan. Iaitu, ia harus sama tanpa mengira di mana atau berapa kali pengukuran dibuat.
-Komposisi kimianya tetap dan tidak sensitif, jadi ia tidak mengalami perubahan apabila ia berinteraksi dengan penyelesaian analit atau merendam dirinya dalam medium berair.
-Sangat mudah dibina dan dipasang, tidak seperti elektrod hidrogen standard, yang menuntut penggunaan tangki hidrogen dan menjalankan risiko letupan apabila hidrogen bercampur dengan udara dengan udara.
Elektrod penunjuk adalah salah satu yang sensitif terhadap kepekatan analit.
Fungsi elektrod rujukan
Potensi elektrod rujukan diukur terhadap elektrod hidrogen standard, jadi nilai mereka berbeza dari 0V. Terima kasih kepada elektrod hidrogen ini, pembinaan jadual berpotensi standard dan º adalah mungkin, yang muncul dalam teks kimia untuk simfin reaksi redoks.
Walau bagaimanapun, dalam praktiknya ia tidak memuatkan elektrod hidrogen di mana sahaja. Sebaliknya, elektrod rujukan digunakan, lebih mudah dan selamat untuk dimanipulasi.
Oleh kerana potensinya adalah tetap dan stabil, pembacaan potensi sel elektrokimia secara eksklusif disebabkan oleh elektrod penunjuk; iaitu, variasi kepekatan analit yang dipersoalkan.
Oleh itu, fungsi elektrod rujukan adalah untuk menentukan potensi sebarang tindak balas dalam salah satu daripada separuh akhir sistem elektrokimia. Sekiranya potensi mereka tidak stabil, maka penentuan kuantitatif analit tidak akan dipercayai. Sebarang analisis potentiometrik atau voltametrik harus menentukan elektrod rujukan yang mereka gunakan untuk melaporkan hasilnya.
Ia boleh melayani anda: Asid Bromous (HBRO2): Ciri -ciri fizikal dan kimia, dan kegunaanContoh elektrod rujukan
Terdapat beberapa elektrod rujukan yang ada di pasaran. Ada yang digunakan untuk penentuan yang sangat spesifik. Walau bagaimanapun, terdapat dua elektrod di antara mereka yang menonjol terima kasih kepada kesederhanaan dan kepraktisan mereka: elektrod calomel, dan perak perak-clloride, kedua-duanya sangat berulang dalam banyak analisis potentiometrik dan voltamletrik.
Elektrod Calomel
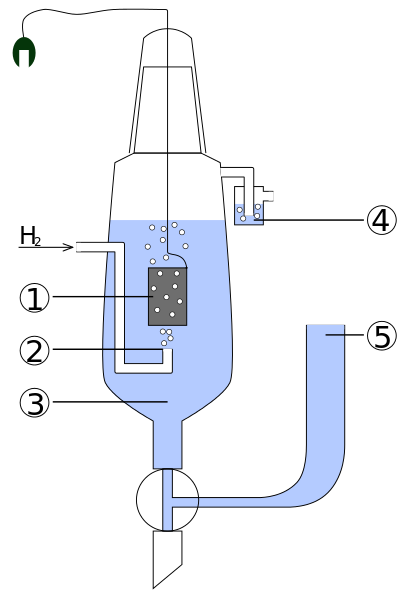
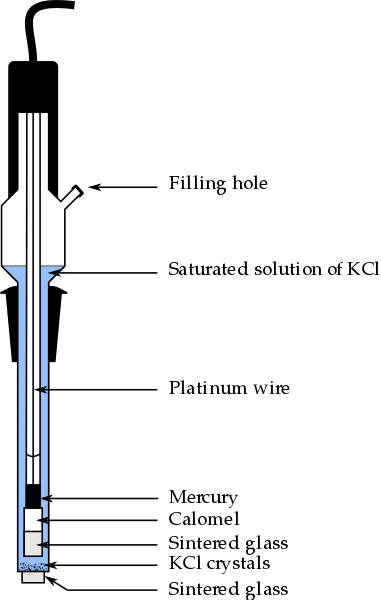 Bahagian elektrod kalomel, salah satu elektrod rujukan yang paling banyak digunakan dalam kimia analisis. Sumber: Bachi-Bouzouk melalui Wikipedia.
Bahagian elektrod kalomel, salah satu elektrod rujukan yang paling banyak digunakan dalam kimia analisis. Sumber: Bachi-Bouzouk melalui Wikipedia. Di bahagian atas, bahagian konvensional elektrod kalomel tepu ditunjukkan, ECS. Dikatakan bahawa ia tepu kerana ia mengandungi penyelesaian tepu KCl (biru), yang juga membentangkan KCL.
Lajur Dalaman, yang dikunjungi oleh dawai platinum, dipenuhi dengan merkuri, yang seterusnya menyentuh pes calomel, HG2Cl2 o merkuri klorida (i), dan penyelesaian tepu KCl. Oleh itu, dalam elektrod ini kepekatan ion Clas adalah penting-, Oleh kerana nilainya mengubah potensi elektrod.
Reaksi yang berlaku adalah seperti berikut:
Hg2Cl2(s) + 2e- ⇌ 2Hg (l) + 2cl-
Dan ia mempunyai eº of 0.241 v.
Di bahagian bawah ECS terdapat goreng berliang, yang diletakkan dalam hubungan elektrik dengan penyelesaian analit dan membolehkan pertukaran ion ion terkawal-. Jika tidak, akan ada pencemaran klorida dalam sampel, dan juga elektrod akan kehilangan penyelesaian KCl tepu yang berharga.
Elektrod ini digunakan untuk pengukuran pH dan secara umum dari mana -mana analit yang kepekatannya dapat ditentukan dalam medium berair.
Ia boleh melayani anda: Alkohol termal: Struktur, sifat, risiko dan kegunaanElektrod perak perak
 Electro perak perak. Sumber: TenOfallTrades (bercakap) (muat naik). / Domain awam
Electro perak perak. Sumber: TenOfallTrades (bercakap) (muat naik). / Domain awam Sama dengan elektrod Calomel, elektrod perak perak terdiri daripada dawai perak yang ditutup dengan klorida perak, dan juga tenggelam dalam larutan tepu oleh campuran KCl dan AGCL.
Semua bahagiannya dilindungi dalam tiub plastik, yang mempunyai pembukaan berliang di mana ia mewujudkan hubungan elektrik dengan penyelesaiannya.
Reaksi yang mentakrifkan potensinya, eº = 0.197 V, adalah seperti berikut:
AGCL (s) + e- ⇌ AG (s)+Cl-
Elektrod ini memberikan kegunaan dan keutamaan yang lebih besar daripada calomel, yang disebabkan oleh kesan negatif merkuri pada alam sekitar. Sebaliknya, elektrod perak perak-pepejal lebih mudah, selamat dan murah untuk dibina di makmal.
Kami mengatakan bahawa elektrod perak-fork menggantikan Calomel dalam banyak aplikasinya (darjah potentiometrik, ujian kakisan, analisis elektrokimia, dll.).
Ia juga merupakan salah satu pilihan pilihan dalam biologi dan perubatan, terutamanya untuk elektrokardiografi dan elektroencephalography, kerana perak atau garam mereka adalah bahan yang agak toksik untuk badan.
Rujukan
- Hari, r., & Underwood, a. (1965). Kimia Analisis Kuantitatif. (Kelima ed.). Pearson Prentice Hall.
- Skoog d.Ke., Barat d.M. (1986). Analisis instrumental. (Kedua ed.). Inter -American., Mexico.
- Wikipedia. (2020). Rujukan elektrod. Diperoleh dari: dalam.Wikipedia.org
- Elsevier b.V. (2020). Rujukan elektrod. Scientedirect. Diperoleh dari: Scientedirect.com
- Kimia Librettexts. (9 Jun, 2020). Elektrod rujukan. Pulih dari: chem.Libretxts.org
- « Alexandria Lighthouse Lokasi, Sejarah, Keterangan, Runtuhan
- Emily Dickinson Biografi, Pencapaian, Kerja, Frasa »

