Tenaga pengaktifan

- 968
- 231
- Julius Dibbert
Kami menerangkan apakah tenaga pengaktifan, formula, unit, bagaimana ia dikira dan kami memberikan beberapa contoh
Apakah Tenaga Pengaktifan?
The tenaga pengaktifan (Danke) Ia ditakrifkan sebagai tenaga minimum yang diperlukan untuk tindak balas kimia yang dilakukan. Dengan kata lain, ia adalah penghalang tenaga yang mesti diatasi supaya reagen dapat menjadi produk.
Tenaga pengaktifan dapat dilihat dalam tindakan dalam kehidupan seharian. Sesungguhnya, kita semua tahu bahawa, ketika membuka kunci laluan gas di dapur, ia tidak membakar dengan segera ketika bersentuhan dengan udara.
Supaya reaksi pembakaran bermula, adalah perlu untuk memberikan percikan atau api perlawanan. Percikan api atau api ini mewakili tenaga pengaktifan reaksi pembakaran.
Mengapa tenaga pengaktifan diperlukan?
Untuk memahami sebab mengapa reaksi memerlukan tenaga minimum yang berlaku, penting untuk difahami, pada mulanya, bagaimana ia berlaku. Untuk dua atom atau molekul untuk bertindak balas, mereka mesti bertembung terlebih dahulu. Di samping itu, mereka mesti melakukannya dengan orientasi yang betul supaya ikatan kimia baru dapat dibentuk dan orang tua dapat memecahkan.
Walau bagaimanapun, walaupun kedua -dua molekul diarahkan kepada satu sama lain dengan orientasi yang sempurna, ini tidak memastikan bahawa perlanggaran yang berkesan diberikan, disebabkan oleh penolakan antara elektron permukaan molekul.
Atas sebab ini, adalah perlu, sebagai tambahan kepada orientasi yang betul, molekul juga bergerak dengan kelajuan atau dengan beberapa tenaga kinetik minimum yang memastikan perlanggaran itu cukup kuat untuk mengatasi penolakan elektron.
Tenaga kinetik minimum yang diperlukan pada tahap mikroskopik adalah yang diterjemahkan ke dalam tenaga pengaktifan tindak balas.
Boleh melayani anda: lithium bromide: struktur, sifat, kegunaan, risikoApa yang dilihat dalam gambarajah tenaga?
Rajah Tenaga adalah perwakilan grafik yang menunjukkan bagaimana tenaga reagen berbeza -beza kerana ia berubah menjadi produk. Dalam gambar rajah ini, seperti yang dibentangkan di bawah, mudah untuk melihat dan mentafsirkan tenaga pengaktifan.

Dalam graf ini garis biru menunjukkan tenaga apabila reaksi berlangsung. Di sini anda dapat melihatnya, untuk menjadi produk, reagen mesti terlebih dahulu mengatasi bukit untuk mencapai keadaan peralihan. Jika tidak, mereka akan dikembalikan ke keadaan awal mereka.
Ketinggian bukit ini adalah tenaga pengaktifan yang tepat. Sekiranya mungkin untuk diatasi, seluruh jalan menurun, dan reagen selesai dengan cepat menjadi produk.
Unit Tenaga Pengaktifan
Tenaga Pengaktifan adalah magnitud intensif yang dinyatakan dalam unit tenaga berbanding massa atau tahi lalat. Memandangkan terdapat unit tenaga yang berbeza dan unit jisim yang berbeza, tenaga pengaktifan boleh dinyatakan dalam beberapa unit yang berbeza. Walau bagaimanapun, yang paling kerap digunakan dalam kimia adalah:
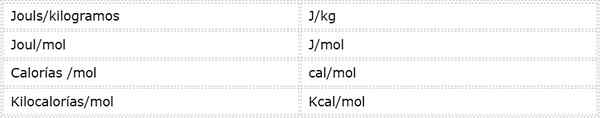
Unit mana yang digunakan bergantung pada data yang dikira, atau penggunaan yang akan diberikan dalam pengiraan lain.
Formula Tenaga Pengaktifan
Tenaga pengaktifan berkaitan dengan kelajuan tindak balas. Malah, semakin besar tenaga pengaktifan, semakin rendah kelajuan. Hubungan ini dinyatakan secara matematik melalui persamaan Arrhenius, yang berkaitan dengan pemalar kelajuan tindak balas terhadap suhu.
Boleh melayani anda: Benedict Reagent: Apa itu, komponen, penyediaan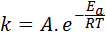
Dalam persamaan ini, k Ia adalah pemalar kelajuan reaksi, danke Ia adalah tenaga pengaktifan, r adalah pemalar gas ideal, t adalah suhu mutlak dan dipanggil faktor pra-eksponen Arrhenius, juga dipanggil faktor perlanggaran.
Persamaan ini boleh disusun semula untuk diberikan:
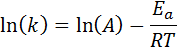
Sekiranya nilai A untuk tindak balas diketahui, maka tenaga pengaktifan dapat diperoleh dengan membersihkan persamaan sebelumnya. Walau bagaimanapun, ini bukan cara di mana tenaga pengaktifan tindak balas biasanya ditentukan. Biasanya pemalar kelajuan ditentukan pada dua atau lebih suhu, yang membuatnya tidak perlu diketahui.
Bagaimana tenaga pengaktifan dikira?
Tenaga pengaktifan ditentukan dari nilai pemalar kelajuan pada suhu yang berbeza. Sekurang -kurangnya dua nilai k diukur pada nilai t yang berbeza untuk mengira tenaga pengaktifan tanpa mengetahui, yang biasanya berlaku.
Bergantung pada berapa banyak nilai k Mereka ada, anda boleh mengira danke Dalam dua cara:
1. Apabila anda mempunyai k pada dua suhu
Dalam kes ini, lebih mudah untuk bermula dari bentuk pertama persamaan Arrhenius. Sekiranya kita memanggil k1 ke pemalar kelajuan pada suhu T1 dan k2 ke pemalar kelajuan pada suhu T2, Kemudian kita boleh menulis persamaan Arrhenius dua kali:
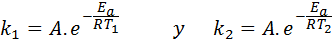
Sekarang, kita boleh membahagikan mana -mana dua persamaan antara yang lain untuk membatalkan A:
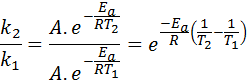
Kemudian, mengambil logaritma Neperian di kedua -dua belah pihak dan menyelesaikan eke, diperoleh:
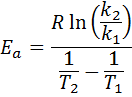
2. Apabila anda mempunyai k lebih daripada dua suhu
Dalam kes di mana terdapat beberapa penentuan kelajuan pemalar pada pelbagai suhu, lebih baik untuk mencari tenaga pengaktifan secara grafik atau dengan regresi linear. Ini berdasarkan persamaan dalam bentuk logaritma, yang mempunyai bentuk garis:
Ia dapat melayani anda: Persamaan Clausius-Clapeyron: Apa itu, Contoh, Latihan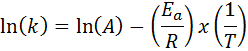
Sekiranya kita membuat graf ln (k) berbanding (1/t), kita akan memperoleh garis lurus yang memotong ke paksi dan di ln (a) dan cerunnya sama dengan -(eke/R). Dari situ tenaga pengaktifan diperolehi.
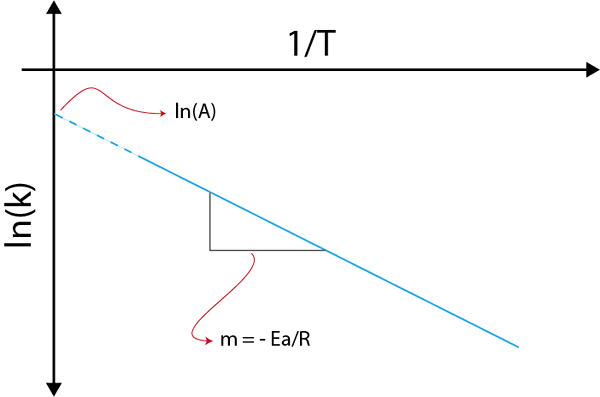 Grafik Arrhenius untuk menentukan tenaga pengaktifan
Grafik Arrhenius untuk menentukan tenaga pengaktifan Contoh pengiraan tenaga pengaktifan
Contoh 1
Pemalar kelajuan tindak balas pertama ditentukan pada dua suhu yang berbeza. 298 K mempunyai nilai 0.058 s-1, manakala pada 350 K nilai meningkat kepada 0.425 s-1. Tentukan tenaga pengaktifan tindak balas ini dalam j/mol.
- Penyelesaian: Memandangkan anda mempunyai pemalar pada dua suhu, formula tenaga pengaktifan yang ditunjukkan di atas boleh digunakan secara langsung. Oleh kerana tenaga diminta dalam unit J/mol, maka kita mesti menggunakan pemalar gas dalam unit -unit ini:
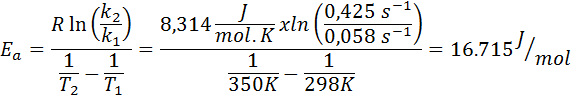
Contoh 2
Pemalar kelajuan untuk tindak balas kimia kedua diukur pada suhu yang berbeza. Nilai dibentangkan dalam jadual berikut. Tentukan tenaga pengaktifan dalam kcal/mol.
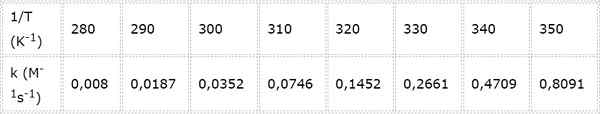
- Penyelesaian: Seperti dalam kes ini terdapat beberapa suhu, lebih baik untuk menentukan tenaga pengaktifan secara grafik. Untuk melakukan ini, graf ln (k) vs 1/t dibuat, yang dibentangkan di bawah.
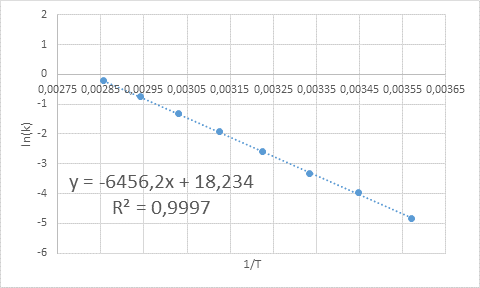 Contoh penentuan grafik tenaga pengaktifan
Contoh penentuan grafik tenaga pengaktifan Dari persamaan garis yang ditunjukkan dalam graf cerun diperolehi, iaitu -6456.2. Kerana cerun (m) sama dengan - eke/R, kemudian:
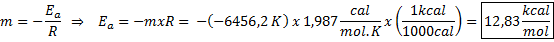
Iaitu, tenaga pengaktifan tindak balas ini ialah 12.83 kcal/mol.

