Tenaga pengionan

- 1284
- 113
- Mr. Tracy Parisian
Apakah tenaga pengionan?
The tenaga pengionan, Diwakili oleh simbol I, ia adalah jumlah minimum tenaga yang diperlukan untuk memulakan elektron luaran ke tahi lalat atom dalam keadaan gas, dalam keadaan asasnya. Dalam erti kata lain, ia adalah jumlah minimum tenaga yang diperlukan untuk mengubah mol atom neutral menjadi keadaan gas menjadi mol ion dengan beban positif (oleh itu namanya).
Dilihat dalam bentuk persamaan kimia, tenaga pengionan akan menjadi tenaga yang diperlukan untuk proses berikut:
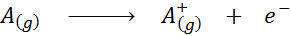
Tenaga pengionan adalah ukuran langsung betapa kuatnya elektron paling luar elemen kimia yang dikaitkan. Apabila menentukan tenaga proses pengionan keadaan gas, sumbangan atau gangguan interaksi intermolecular yang berlaku dalam keadaan cecair dan pepejal dielakkan.
Dengan cara ini, ia memastikan bahawa tenaga pengionan hanya bergantung kepada daya dalaman atom dan, khususnya, pada kestabilan elektron yang membentuk lapisan valensi setiap elemen.
Proses mengeluarkan elektron dari lapisan Valencia adalah proses yang memerlukan tenaga, jadi ia adalah proses endotermik. Atas sebab ini, tenaga pengionan sentiasa positif (oleh konvensyen, apabila tenaga memasuki sistem dianggap positif).
Terdapat lebih daripada satu tenaga pengionan
Walaupun definisi tenaga pengionan digunakan untuk atom neutral yang menjadi ion positif (iaitu, kation), ia juga boleh digunakan untuk penyingkiran elektron ion positif berturut -turut, ia.
Dalam pengertian ini, tenaga untuk mengionkan atom neutral menjadi hanya yang pertama dari banyak tenaga pengionan yang mungkin, kerana ada satu untuk setiap elektron yang berkisar di sekitar nukleus.
Dapat melayani anda: apakah unsur -unsur pergerakan?Dalam erti kata lain, tenaga yang berkaitan dengan semua proses berikut dianggap tenaga pengionan:
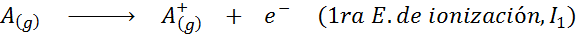
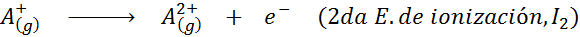
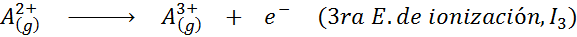
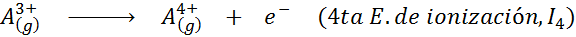
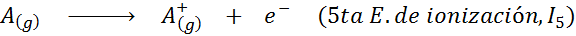
Susunan tenaga pengionan berturut -turut
Bagi mana -mana atom dari mana -mana elemen, ia dipenuhi bahawa tenaga pengionan akan selalu lebih besar daripada semua tenaga pengionan sebelumnya. Dengan kata lain, tenaga pengionan berturut -turut mempunyai hubungan berikut:
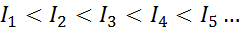
Sebab mengapa ini berlaku sangat mudah. Tenaga pengionan pertama melibatkan mengeluarkan elektron ke atom neutral. Walau bagaimanapun, tenaga pengionan kedua membayangkan mengambil elektron ke atom yang telah kehilangan yang pertama.
Ketiadaan elektron meninggalkan beban bersih positif yang menarik lebih banyak kekuatan elektron yang tinggal, jadi mereka lebih sukar untuk memulakan. Di samping itu, ketiadaan ini juga mengurangkan kesan perisai yang dimiliki oleh elektron pada elektron paling luar, jadi nukleus dapat menarik mereka lebih kuat.
Hasilnya ialah lebih sukar untuk memulakan elektron kedua daripada yang pertama, dan lebih sukar untuk memulakan yang ketiga daripada yang kedua, dan sebagainya, seperti yang dapat dilihat dalam jadual tenaga pengionan berikut untuk 10 elemen pertama dari jadual berkala.
Z | Elemen | Pertama | Kedua | Ketiga | Suku | Kelima | Keenam |
1 | H | 1312 | |||||
2 | Dia | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Menjadi | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | Sama ada | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Trend tenaga pengionan berkala
Tenaga pengionan adalah harta berkala yang meningkat dari kiri ke kanan dan dari bawah ke jadual berkala, seperti yang dapat dilihat dalam grafik berikut.
Boleh melayani anda: dilebarkan linear: Apa itu, formula dan pekali, contohnya
Variasi saya dalam tempoh
Apabila kita bergerak dalam tempoh dari kiri ke kanan, agak dipanggil beban nuklear yang berkesan secara progresif dipanggil, yang tidak lebih daripada beban positif sebenar yang elektron terluar dapat "melihat" kerana perisai elektron yang paling dalaman.
Ini bermakna bahawa daya yang nukleus dapat menarik elektron Valencia semakin meningkat, sehingga menjadi lebih sukar untuk merobeknya dan tenaga yang diperlukan (iaitu, tenaga pengionan) menjadi lebih besar.
Variasi saya sepanjang satu kumpulan
Apabila turun dalam kumpulan, kita meletakkan elektron dalam peningkatan tahap tenaga dan, oleh itu, dalam orbital atom semakin jauh dari nukleus. Atas sebab ini, daya yang nukleus menarik elektron valensi berkurangan ketika kita turun dalam kumpulan, juga mengurangkan tenaga pengionan.
Cara menentukan tenaga pengionan?
Tenaga pengionan adalah jumlah eksperimen melalui satu siri teknik yang dipanggil, bersama -sama, spektroskopi fotoelektron.
Teknik -teknik ini didasarkan pada fenomena yang sangat mirip dengan kesan fotoelektrik, di mana radiasi elektromagnet dapat memulakan elektron atom, dan perbezaan antara tenaga radiasi dan tenaga kinetik yang dipecat elektron mewakili tenaga pengionan.
Teknik spektroskopi fotoelektron yang berbeza membolehkan menganalisis tenaga yang hampir sama ada elektron dikaitkan dengan nukleusnya, sama ada elektron valencia atau elektron dalaman.
Contoh tenaga pengionan
Tenaga pengionan pertama gas mulia
Gas mulia mempunyai konfigurasi elektronik yang paling stabil dari semua elemen jadual berkala. Atas sebab ini, mereka juga mempunyai tenaga pengionan terbesar. Tenaga pengionan pertama setiap gas mulia dibentangkan di bawah:
-
Helium
Tenaga pengionan pertama ialah 2373 kJ/mol, yang tertinggi dalam keseluruhan jadual berkala.
-
Neon
Tenaga pengionan pertama ialah 2080 kJ/mol dan merupakan yang kedua tertinggi.
-
Argon
Tenaga pengionan pertama ialah 1521 kJ/mol. Hanya F, NE dan dia mempunyai tenaga pengionan yang lebih besar.
-
Kripton
Tenaga pengionan pertama ialah 1350 kJ/mol. Ia tidak setinggi yang lain, tetapi ia masih lebih besar daripada unsur -unsur jirannya.
-
Xenon
Perkara yang sama yang dikatakan mengenai Kripton boleh dikatakan mengenai xenon dengan tenaga pengionan pertama sebanyak 1170 kJ/mol.
Boleh melayani anda: lubang cacing: sejarah, teori, jenis, pembentukanTenaga pengionan pertama dan kedua logam alkali
Logam alkali mempunyai tenaga pengionan pertama yang sedikit dan tenaga pengionan kedua terbesar bagi semua elemen:
-
Lithium
Tenaga pengionan pertama adalah kurang daripada seperempat daripada dia, tetapi litium mempunyai tenaga pengionan kedua terbesar dari semua unsur, iaitu 7300 kJ/mol.
-
Natrium
Natrium kehilangan elektron pertamanya dengan mudah, kerana ia memperoleh konfigurasi elektronik NE, tetapi untuk menghapuskan elektron kedua anda perlu membekalkan 4560kj/mol.
-
Potasium
Tenaga pengionan kalium pertama hanya 418.7 kJ/mol, manakala yang kedua ialah 3052 kJ/mol, jauh lebih besar daripada jirannya.
-
Rubidium
Dengan tenaga pengionan 403 kJ/mol, Rubidio adalah salah satu elemen dengan tenaga pengionan yang kurang. Walau bagaimanapun, yang kedua ialah 2633 kJ/mol.
-
Cesium
Tenaga pengionan pertama hanya 375 kJ/mol dan 2234 kJ/mol kedua, lebih rendah daripada tenaga pengionan helium pertama.

