Ikatan kovalen
- 1480
- 190
- Clarence Greenholt DDS
Apa itu pautan kovalen?
Ikatan kovalen adalah interaksi yang kuat yang membolehkan dua atau lebih atom bergabung untuk membentuk molekul. Ini adalah salah satu jenis ikatan kimia di mana beberapa elektron mengambil bahagian yang berasal dari orbital paling luar atom yang dikaitkan.
Secara teorinya, setiap atom menyumbang salah satu daripada dua elektron ketika menghubungkan kovalen, sehingga mereka memenangi kestabilan. Sepasang elektron, yang menjadi sejenis "cangkuk elektronik" antara kedua -dua nukleus atom, dikongsi bersama antara dua atom yang sama, tetapi ini tidak berlaku apabila kedua -dua atom itu terdiri daripada dua elemen yang berbeza.
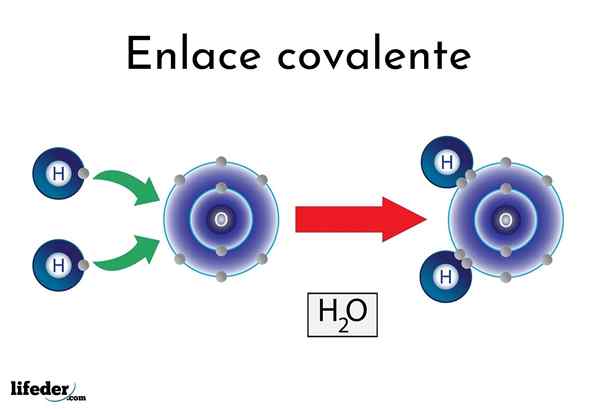
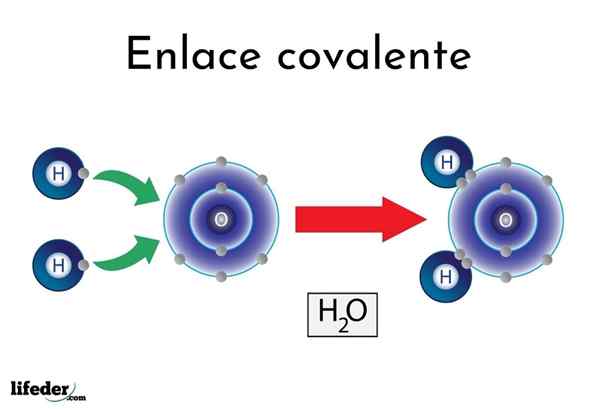 Ikatan kovalen air
Ikatan kovalen air Terdapat atom atau unsur yang mempunyai kecenderungan semula jadi untuk menghasilkan elektron, sementara yang lain lebih suka memenanginya.
Sebagai contoh, molekul air yang terkenal, h2Atau, ia mempunyai dua pautan kovalen: H-O-H. Hidrogen dan oksigen berkongsi dua pasang elektron, tetapi orbit ini lebih dekat dengan atom oksigen daripada hidrogen. Fenomena ini disebabkan oleh polariti dan elektronegativiti.
Ciri -ciri ikatan kovalen
Bon kovalen membentangkan ciri -ciri berikut:
-Mereka melibatkan beberapa elektron untuk setiap ikatan kovalen.
-Panjangnya biasanya dinyatakan dalam unit PM (picometers) atau Armstrong (Å).
-Mereka sukar untuk pecah, yang bermaksud mereka sangat kuat.
-Apabila mereka pecah, perubahan kimia atau transformasi berlaku, kerana molekul kehilangan atom. Dalam proses ini tenaga diserap.
-Apabila mereka terbentuk, molekul baru dilahirkan. Dalam proses ini tenaga dilepaskan.
Boleh melayani anda: Reaksi Kimia: Ciri, Bahagian, Jenis, Contoh-Panjangnya berbeza -beza mengikut kehebatan bahawa salah satu atom yang dikaitkan mempunyai ke arah pasangan elektron; Iaitu, semakin menariknya, pautan kovalen dipanjangkan.
-Ikatan kovalen paling mudah hanya wujud di antara dua atom pada masa yang sama, dan diwakili dengan skrip atau garis (-).
Terdapat ciri -ciri lain yang memohon pautan kovalen yang lebih kompleks, yang bagaimanapun juga sesuai dengan apa yang dikomentari di atas.
Jenis pautan kovalen
Bon kovalen dapat diklasifikasikan, pada dasarnya, dalam dua cara: mengikut bilangan elektron yang dikongsi, dan menurut polaritas yang terhasil apabila molekul terbentuk. Kedua -duanya akan diterangkan secara dangkal di bawah.
Menurut bilangan elektron bersama
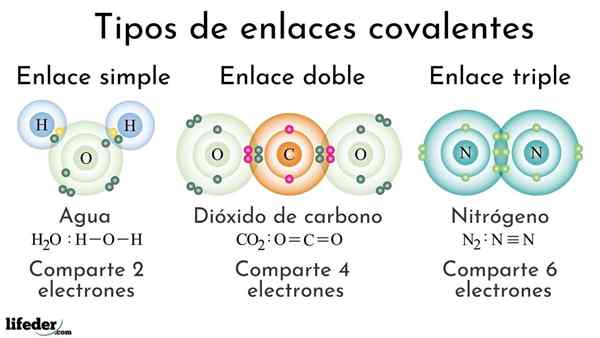 Jenis bon kovalen Menurut bilangan elektron bersama
Jenis bon kovalen Menurut bilangan elektron bersama Bon kovalen Menurut bilangan elektron yang dikongsi dapat diklasifikasikan sebagai mudah, berganda atau tiga. Di bahagian atas, pautan masing -masing untuk tiga molekul yang akan dibincangkan di bawah ditunjukkan.
-
Mudah
Ikatan kovalen yang mudah adalah satu di mana terdapat hanya beberapa elektron, iaitu dua elektron. Contoh pautan ini yang kita lihat dalam molekul air, h2Sama ada. Perhatikan bahawa semua ikatan kovalen, mudah, i-i, adalah yang paling lama dari semua. Ini hampir selalu.
-
Ganda
Dalam ikatan kovalen berganda kita ada, seperti namanya, dua pasang elektron, yang bermaksud terdapat empat elektron yang menguatkan "cangkuk elektronik" antara kedua -dua atom yang dipautkan.
Iaitu, ikatan berganda (=) lebih kuat daripada yang mudah (-). Walau bagaimanapun, ia lebih reaktif, yang walaupun ia mungkin kelihatan bercanggah, mudah dijelaskan memandangkan tumpang tindih orbital atom.
Boleh melayani anda: polariti (kimia): apakah, definisi, contohContoh pautan ini dilihat dalam molekul karbon dioksida, CO2. Kedua -dua atom oksigen tetap bersatu dengan karbon terima kasih kepada ikatan ini, atau = c = o, yang, untuk menjadi lebih kuat, lebih dekat dengan atom; Dan seterusnya ini membawa kepada pautan yang dipendekkan.
-
Triple
Pautan triple adalah ikatan kovalen terkuat dan terpendek (biasa). Perhatikan bahawa untuk molekul nitrogen, n2 atau N≡N, atom mereka yang diwakili oleh sfera kebiruan sangat dekat antara satu sama lain.
Dalam pautan triple kita mempunyai tiga pasangan elektron, yang sama dengan enam elektron yang menguatkan ikatan kovalen antara kedua -dua atom.
-
Dative
Pautan Dative adalah jenis khas pautan mudah yang terdiri daripada pasangan elektron hanya datang dari salah satu daripada dua atom yang dipautkan. Iaitu, ia dapat dilihat sebagai "perkongsian paksa".
Contohnya, molekul m2Atau gunakan salah satu pasangan bebas oksigen untuk mendermakannya kepada ion h+ (H2O: → h+ = [H2O-H]+ atau h3Sama ada+).
Menurut Polarity
Ikatan kovalen mengikut kutub boleh diklasifikasikan sebagai kovalen polar, atau kovalen bukan polar.
-
Ikatan kovalen kutub
Ia berlaku di antara dua atom yang berlainan yang perbezaan elektronegativiti besar. Ini mengakibatkan pembentukan dipole, di mana atom menumpukan secara negatif (menarik elektron), sementara yang lain menumpukan secara positif (menghasilkan elektron). Sebagai contoh, ikatan kovalen HF (H-F) adalah kutub, kerana fluorida lebih banyak elektronegatif daripada hidrogen.
-
Pautan kovalen bukan -polar
Ia berlaku di antara dua atom yang sama yang perbezaannya dalam elektronegativiti adalah sifar atau sangat kecil. Molekul yang disebutkan di atas: i2, Sama ada2 dan n2 Mereka membentangkan ikatan kovalen bukan kovalen. Oleh itu, elektron berada di sekitar kedua -dua atom dengan kekerapan yang sama.
Ia boleh melayani anda: urethane: struktur, sifat, mendapatkan, menggunakanContoh pautan kovalen
Akhirnya, bon kovalen lain akan disenaraikan sebagai tambahan kepada yang telah dijelaskan, juga menunjukkan jenis mereka:
H2S (H-S-H), kovalen polar sederhana | HCL (H-CL), pautan kovalen mudah polar |
H2 (H-H), bukan kovalen mudah polar | C2H4 (H-C≡C-h), dengan dua pautan kutub mudah (c-h) dan pautan bukan polar tiga (c≡C) |
F2 (F-F), kovalen bukan polar sederhana | P2 (ms≡P), ikatan kovalen bukan -popolar (atau apolar) |
CO₂ (O = C = O), kovalen polar berganda | S2 (s = s), ikatan kovalen ganda bukan -polar |
HCN (H-C≡N), dengan ikatan kovalen kutub mudah (H-C), dan satu lagi pautan kutub (c≡N) | NH3 (N-H), dengan tiga ikatan kovalen kutub mudah |
Contoh yang dipetik sesuai dengan molekul kecil. Tetapi ikatan kovalen hadir dalam semua molekul sedia ada, termasuk polimer, biomolekul, makromolekul, mineral, seramik, hidrokarbon, antara lain.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- María Estela Raffino. (28 Jun, 2020). Ikatan kovalen. Konsep.dari. Pulih dari: konsep.dari
- Wikipedia. (2020). Ikatan kovalen. Diperoleh dari: dalam.Wikipedia.org
- Camy Fung & Nima Mirzaee. (15 Ogos 2020). Ikatan kovalen. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Helmestine, Anne Marie, Ph.D. (27 Ogos 2020). Apakah ikatan kovalen dalam kimia? Pulih dari: Thoughtco.com

