Ikatan kovalen berganda

- 1491
- 395
- Ms. Edgar Carroll
Kami menerangkan apa ikatan kovalen berganda, ciri -cirinya dan memberi beberapa contoh
 Molekul eteno atau etilena. Ini adalah contoh tipikal ikatan kovalen berganda antara dua atom karbon
Molekul eteno atau etilena. Ini adalah contoh tipikal ikatan kovalen berganda antara dua atom karbon Apakah ikatan kovalen berganda?
The ikatan kovalen berganda Mereka adalah pautan kimia di mana dua atom berkongsi dua pasang elektron. Dalam erti kata lain, mereka adalah ikatan kovalen yang dibentuk oleh sejumlah empat elektron valensi yang berputar di sekitar dua atom.
Pautan berganda sangat biasa dalam sebatian organik. Sebagai contoh, semua alkena mempunyai ikatan karbon-karbon berganda. Banyak kumpulan fungsional lain seperti aldehid, keton, asid karboksilik dan amida juga mempunyai ikatan kovalen berganda antara karbon dan oksigen. Yang lain, seperti imine mempunyai ikatan kovalen berganda c = n.
Pautan berganda mempunyai banyak ciri yang membezakannya dari jenis ikatan kovalen lain seperti pautan mudah dan pautan tiga. Mereka berbeza dalam bentuk molekul yang mengandungi mereka, dalam kekuatan panjang dan pautan dan ciri -ciri lain yang berkaitan dengan sifat kimia mereka.
Ciri -ciri pautan kovalen berganda
Mereka dibentuk oleh 4 elektron
Sebab mengapa ikatan berganda adalah kerana ia mengandungi elektron ganda ikatan kovalen yang mudah, yang terbentuk apabila dua atom berkongsi dua elektron valensi. Ini bermaksud bahawa setiap ikatan berganda mengandungi 4 elektron.
Ia dibentuk oleh pautan sigma (σ) dan pautan pi (π)
Daripada 4 elektron yang membentuk ikatan berganda, 2 daripadanya akan datang dan datang antara satu atom dan satu lagi, melalui pusat kedua. Sepasang elektron ini dipanggil elektron sigma, kerana mereka membentuk ikatan sigma (σ).
Sepasang elektron lain terapung di atas dan di bawah kedua -dua atom membuat sejenis sandwic. Elektron ini dipanggil elektron Pi dan membentuk pautan Pi (π).
Boleh melayani anda: chlorobenzene (c6h5cl)Bersama -sama, pautan sigma dan pautan pi membentuk ikatan kovalen berganda.
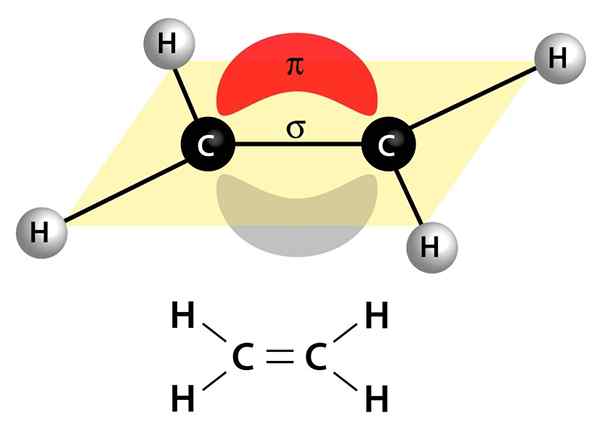 Imej ini menunjukkan dua pautan yang membentuk ikatan berganda: pautan Pi yang muncul sebagai awan merah dan kelabu yang berada di atas dan di bawah molekul, dan pautan sigma yang merupakan garis yang bergabung dengan kedua -dua nukleus melalui pusat
Imej ini menunjukkan dua pautan yang membentuk ikatan berganda: pautan Pi yang muncul sebagai awan merah dan kelabu yang berada di atas dan di bawah molekul, dan pautan sigma yang merupakan garis yang bergabung dengan kedua -dua nukleus melalui pusat Mereka boleh menjadi kutub atau apolar
Bergantung pada elektronegativiti atom yang bersatu dengan ikatan kovalen berganda, ia boleh menjadi kutub atau apolar.
Contohnya, ikatan kovalen berganda C = c Ia akan menjadi pautan apolar, kerana kedua -dua atom adalah sama dan mempunyai elektronegativiti yang sama. Sebaliknya, ikatan kovalen berganda C = O Ia akan menjadi kutub, kerana oksigen lebih banyak elektronegatif daripada karbon.
Mereka lebih kuat daripada pautan mudah
Memecahkan ikatan berganda lebih sukar daripada memecahkan hubungan mudah antara dua atom yang sama. Ini kerana, untuk memecahkan ikatan berganda, kedua -dua pautan sigma (yang sama dengan pautan mudah) dan pautan PI mesti dipecahkan. Oleh kerana dua pautan mesti dipecahkan bukannya satu, ikatan berganda lebih kuat daripada yang mudah.
Mereka lebih lemah daripada pautan tiga
Berbanding dengan pautan triple, ikatan berganda lebih lemah dan lebih mudah untuk pecah. Alasannya adalah sama seperti sebelumnya, hanya, dalam kes ini, ikatan berganda mempunyai pautan yang kurang daripada pecah berbanding dengan pautan triple.
Mereka lebih pendek daripada pautan sederhana
Menjadi pautan yang lebih kuat daripada pautan mudah, ikatan berganda dapat membawa atom yang dikaitkan lebih dekat daripada pautan mudah daripada pautan mudah. Atas sebab ini, jika pautan dua c = c dibandingkan dengan pautan C-C yang mudah, yang pertama selalu lebih pendek daripada yang kedua.
Boleh melayani anda: Natrium thiosulfate (Na2S2O3)Mereka lebih panjang daripada pautan tiga
Sekali lagi, apabila pautan triple lebih kuat daripada pautan ganda, pautan triple lebih pendek. Ini menunjukkan bahawa ikatan kovalen berganda lebih panjang daripada tiga.
Mereka adalah pautan tegar.
Ikatan kovalen sederhana agak fleksibel dan juga boleh berputar. Sebaliknya, ikatan berganda tegar, mereka tidak fleksibel dan tidak boleh diputar, kerana pautan Pi yang disebutkan di atas akan dipecahkan.
Mereka mewakili ketidakpastian
Molekul yang mempunyai ikatan berganda akan mempunyai dua atom hidrogen yang kurang berkaitan dengan yang mungkin. Atas sebab ini, dikatakan bahawa ikatan berganda mewakili ketidakpastian (setiap tidak tepu sepadan dengan 2 hidrogen).
Mereka membentuk molekul berbentuk segitiga rata
Atom karbon yang membentuk ikatan kovalen berganda dan dua ikatan mudah lain, selalu membentuk molekul rata di mana tiga ikatan menunjuk ke hujung segitiga. Borang ini dipanggil geometri trigonal rata.
Contoh ikatan kovalen berganda
Pautan c = c dalam etilena
Ethylene adalah salah satu contoh paling mudah dari ikatan kovalen berganda, dalam kes ini antara dua atom karbon.
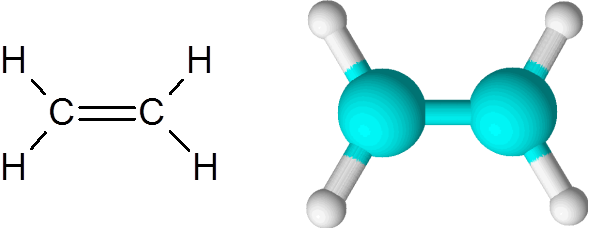 Molekul etilena
Molekul etilena Molekulnya benar -benar rata dan tidak mungkin untuk memutar pautan ke mana -mana arah. Ikatan berganda ini benar -benar apolar, kerana ia menghubungkan dua atom yang sama.
Pautan c = o dalam aseton
Semua keton mengandungi kumpulan karbonil, yang terdiri daripada atom karbon dan atom oksigen bersatu dengan ikatan kovalen berganda.
Boleh melayani anda: Apakah kinetik kimia?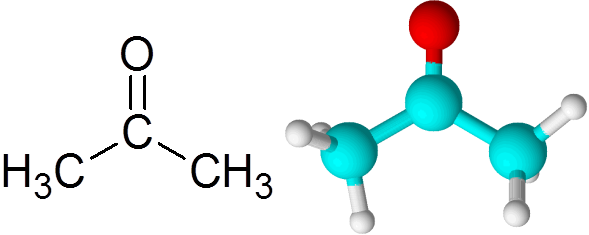 Molekul aseton
Molekul aseton Setiap atom menyumbang dua elektron yang hilang untuk membentuk kedua -dua pautan Pi dan Sigma yang membentuk ikatan berganda. Kebanyakan tindak balas kimia yang berlaku kepada keton adalah disebabkan oleh ikatan berganda c = o.
Pautan o = atau dalam molekul ozon (atau3)
Dalam kes ini, atom oksigen pusat dikaitkan dengan dua atom oksigen lain. Salah satu daripada dua ikatan dibentuk oleh 4 elektron, jadi ia sepadan dengan ikatan kovalen berganda. Tiga atom dan beberapa elektron tanpa berkongsi yang mempunyai atom oksigen pusat semuanya berada dalam satah yang sama dari skrin yang menunjuk ke sudut segitiga.
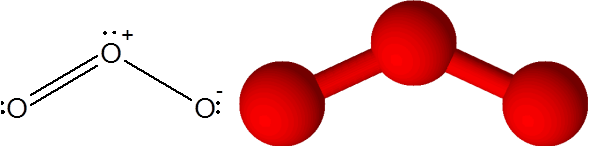 Molekul ozon
Molekul ozon Ozon mempunyai keanehan bahawa ikatan berganda dapat "melompat" dari salah satu oksigen terminal ke yang lain. Malah, dia melakukannya dengan cepat melalui proses yang disebut resonans.
C = c pautan di butadieno (c4H6)
Butadieno adalah contoh sebatian organik yang mempunyai dua ikatan kovalen ganda c = c.
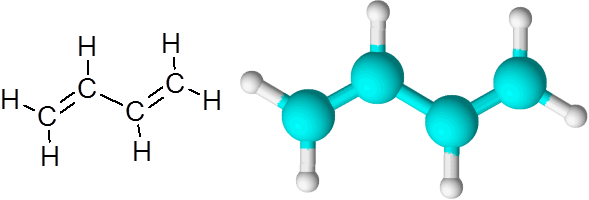 1.3-butadiena molekul
1.3-butadiena molekul Apabila ikatan berganda dengan cara ini, dipisahkan oleh satu pautan mudah, dikatakan bahawa mereka adalah pautan ganda konjugasi.

